要问血小板的主要生理学功能,大家可能都知道是凝血和止血。然而,随着研究的深入,科学家们逐渐意识到血小板的功能可能不仅仅是这些。研究表明,血小板在炎症反应、血栓形成等生理和病理过程中有重要作用。而最近的一项研究表明,血小板通过抑制 T 细胞能帮助癌细胞“躲过”免疫系统的追杀,成为癌细胞为害人间的“保护伞”。
来自美国南卡罗莱纳医科大学(MUSC)的 Zihai Li 教授率领其团队,首次发现血小板会释放活化的转化生长因子β(TGF-β)来抑制 T 细胞的功能,从而帮助癌细胞在免疫系统的攻击下生存下来。近年来的研究表明活化的 TGF-β对于肿瘤生长具有重要意义,而他们发现血小板可表达糖蛋白 A 主导重复序列(GARP),这种蛋白能够捕获和激活 TGF-β,这使得血小板变成了活化的 TGF-β的主要来源。此外,实验表明,添加常见的抗血小板药物如阿司匹林,可大大提高 T 细胞疗法对黑色素瘤的疗效。相关成果发表于 Science Immunology 杂志上。

Zihai Li 教授。图片来源:MUSC
Zihai Li 教授是 MUSC 微生物和免疫学系的主任,主要研究肿瘤逃避免疫系统的机理。研究人员以血小板缺陷的小鼠为对象,给其接种黑色素瘤,他们发现,相比于有正常血小板的小鼠,这种黑色素瘤生长得更慢,且 T 细胞更加活跃。
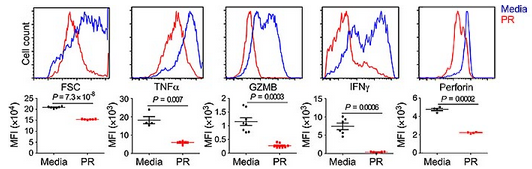
血小板抑制 T 细胞活性。图片来源:Sci. Immunol.
接下来,研究人员从人和小鼠抽取的血液中分离血小板和 T 细胞。他们发现,在这两种情况下,具有凝血活性的血小板会抑制 T 细胞活性。他们进一步使用质谱法鉴定了这种可抑制 T 细胞的分子是 TGF-β。
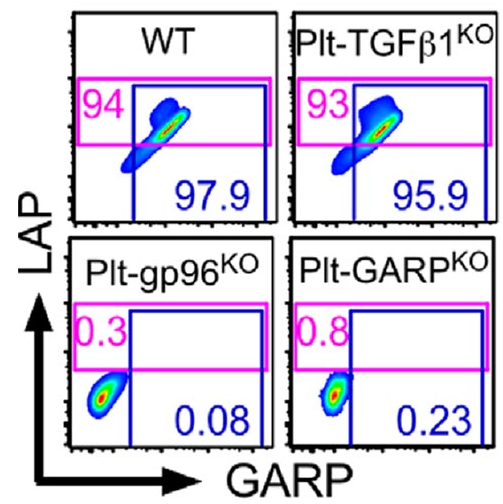
GARP 在激活 TGF-β中起着关键作用。图片来源:Science Immunology
可是血小板是如何激活 TGF-β的呢?在没有 GARP 基因的小鼠中,T 细胞疗法对黑素瘤更为有效。这意味着如果血小板没有通过 GARP 捕获并激活 TGF-β,将不能抑制 T 细胞。
最后,研究人员在 T 细胞疗法中加入两种抗血小板药物的阿司匹林和氯吡格雷,他们发现,受治疗的小鼠存活时间更长,而且复发更少。
这项研究可以指导未来治疗黑色素瘤和其他癌症,并为在过继性 T 细胞疗法(adoptive T cell therapy)临床试验中测试抗血小板药物提供了实验数据支持。目前,治疗黑色素瘤的标准治疗方案是检查点抑制剂,而不是过继性 T 细胞疗法。
当然,小鼠身上的实验结果能否在人类身上重现尚属未知,还需要更多工作要做。Zihai Li 教授打算测试某些检查点抑制剂与阿司匹林、氯吡格雷联合治疗晚期癌症患者的效果,目前正在等待临床试验的批准。
http://immunology.sciencemag.org/content/2/11/eaai7911扫描上面二维码在移动端打开阅读





