近日,清华大学药学院刘刚教授课题组在国际上首次报道了拮抗模式识别受体 NOD2 介导的炎症信号通路可增敏化疗药紫杉醇(PTX)的疗效,实现了负调节肿瘤微环境,逆转化疗抵抗并抑制肿瘤转移。基于此研究思路,刘刚教授课题组将化学治疗及免疫治疗的双功能整合在一个分子中,成功开发了 1.1 类抗肿瘤新药康莫他赛,目前已获批开展临床试验。
针对肿瘤微环境的免疫治疗药物是目前的研究热点。肿瘤微环境中多种炎性细胞、炎性介质以及炎症信号通路中的重要蛋白已经作为药物靶点,在临床治疗肿瘤的试验及应用中取得了备受瞩目的效果。康莫他赛的作用靶点 NOD2 属 NLRs 家族,是机体中一类重要的固有模式识别受体(PRRs),PRRs 主要识别病原相关模式分子(PAMPs)及损伤相关模式分子(DAMPs),启动固有免疫应答及 / 或获得性免疫应答,对于肿瘤相关炎症的触发至关重要,在肿瘤免疫微环境的塑造(或重塑)、肿瘤生长及转移的进程中发挥了重要作用。刘刚教授课题组的研究结果显示,紫杉醇在治疗过程中产生的 DAMPs 可能激活肿瘤微环境中免疫细胞的 NOD2 信号通路,产生炎性因子、趋化因子并募集髓样抑制细胞(MDSCs),从而恶化肿瘤微环境,抵抗化疗药物的治疗效果,并促进肿瘤的侵袭、转移。康莫他赛原型药主要通过拮抗 DAMPs 对 NOD2 激活,显著增敏紫杉醇的抗肿瘤作用并抑制肿瘤的转移。
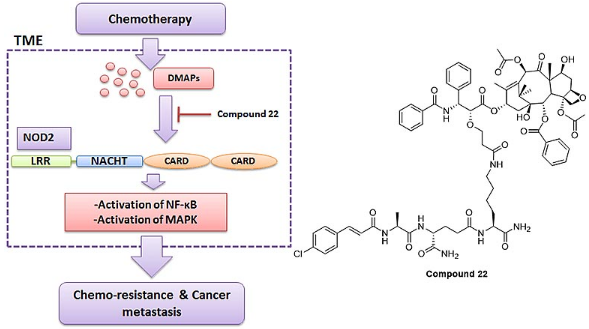
该研究工作首次提出以 NOD2 拮抗剂作为抗肿瘤药物的研发对象,与化疗药物合用抑制肿瘤的生长及转移,为肿瘤的免疫治疗提供了新思路与新策略。研究团队基于此策略成功开发的抗肿瘤新药康莫他赛兼具化疗和免疫治疗双靶点的作用特点,有望替代现有的紫杉烷类药物,带来巨大的经济效益和社会效益。该文章第一作者是清华大学药学院博士后董毅和中国医学科学院药物研究所博士生王素华。
http://pubs.acs.org/doi/abs/10.1021/acs.jmedchem.6b01704
扫描上面二维码在移动端打开阅读





