不久前,诺华 CAR- T 疗法上市申请获得 FDA 全票通过的新闻让大家都很振奋,CAR- T 的“神通”我们也已经给大家介绍过不少了,但是,对于实体瘤,CAR- T 一直久攻不下。而现在,来自宾夕法尼亚大学的研究人员发现,改造过的工程化巨噬细胞竟然能迅速缩小实体瘤!
研究发表在《细胞》杂志的子刊《Current Biology》上。在研究中,两次注射改造后的巨噬细胞使得移植了人肺癌细胞小鼠的实体瘤减小了 80% 之多 [1]!在抗癌战斗中,巨噬细胞一直被认为是颗“墙头草”,一言不合就放弃对癌细胞的吞噬,甚至还会倒戈,阻止 T 细胞发动攻击,分泌生长因子滋养癌细胞,促进肿瘤血管的生成 [2]。即使如此,依然有很多研究人员没有放弃巨噬细胞,他们希望能像改造 T 细胞成为 CAR- T 一样,让巨噬细胞“迷途知返”,重新成为抗癌利器!宾夕法尼亚大学的 Dennis E. Discher 教授(新研究的通讯作者)就是其中之一。

Dennis E. Discher 教授
Discher 教授是怎么改造巨噬细胞的呢?在回答这个问题前,奇点糕要问问大家,是什么蒙蔽了巨噬细胞,让它放弃了吞噬癌细胞?答案就是 CD47 蛋白!CD47 蛋白可以向巨噬细胞传递一个“不要吃我”的信号,健康的细胞都会表达这种蛋白,表明自己是“良民”,巨噬细胞就不会吞噬掉它们 [3]。
然而,狡猾的癌细胞也发现了这个“秘密”,它们本来会表达 CSF1 蛋白,向巨噬细胞发出“吃我”的信号,而知道了这个“良民证”的存在后,癌细胞就也大量表达 CD47 蛋白,扰乱了巨噬细胞的判断,帮助自己躲过一劫。
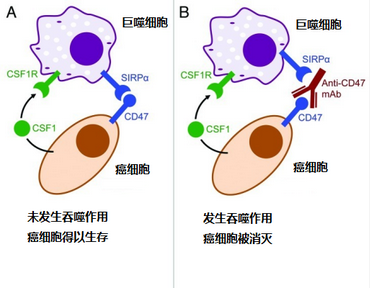
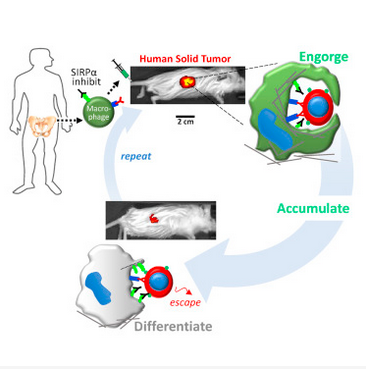
既然是信号传递,那么巨噬细胞表面一定需要一个 CD47 的“信号接收器”,那就是信号调节蛋白α(SIRPα)。那么这是不是意味着,如果在体内抑制 SIRPα的表达,巨噬细胞就可以恢复敏锐的判断力,吞噬癌细胞了呢?这并不是一个新鲜的想法,有不少科学家都在开发 CD47 抗体,阻止它与 SIRPα结合。然而,这些药物往往都存在一个共同问题:巨噬细胞会变得“敌我不分”,在减小了肿瘤的同时,也迅速消灭了血液循环中的血细胞,这除了会引起贫血外,更严重的是会导致自身免疫疾病,结果接受治疗的小鼠没被肿瘤“害死”,倒是先倒在了自身免疫疾病上 [4,5]。
为了解决这个问题,Discher 教授的团队决定“放弃”自身的巨噬细胞,采用外源巨噬细胞。他们从健康人和小鼠的骨髓中获得了“年轻健壮”的巨噬细胞,阻断了其表面 SIRPα的表达,再给它们装载上人的免疫球蛋白 G(IgG),它是血清中最主要的抗体成分,可以增强巨噬细胞的吞噬能力。研究人员首先进行了体外实验,他们在实验室中模拟了包含肿瘤的组织,发现两种来源的巨噬细胞都可以在肿瘤组织中特异性积累,并且吞噬肿瘤。
在体外实验中观察到了初步结果后,研究人员就开始了小鼠实验。他们通过尾部静脉注射的方式将人的肺癌细胞注射入小鼠体内,培养出横截面约 1cm2 大小的肿瘤,再将缺少 SIRPα的巨噬细胞注射给小鼠,和体外实验类似的,这些巨噬细胞只在肿瘤中积聚,而不会出现在其他的组织中。他们发现,有 30% 的健康小鼠的巨噬细胞能够吞噬肿瘤,而患癌小鼠自身的巨噬细胞只有 5% 不到,即使是敲低了 CD47 基因的肿瘤,也只能将它们自身巨噬细胞吞噬的比例提高到 12%。在 3 天的时间中,改造后的巨噬细胞让肿瘤减小了 25%!
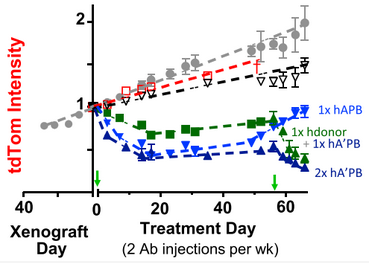
治疗期间小鼠肿瘤大小的变化,灰色为不做干预的对照组;红色为注射不阻断 SIRPα也不含 IgG 的供体巨噬细胞;黑色为阻断 SIRPα但不含 IgG;绿色方块为不阻断 SIRPα但含 IgG;绿色三角为在绿色方块后继续注射一次阻断 SIRPα且含 IgG 的巨噬细胞;浅蓝色为注射一次阻断 SIRPα但不含 IgG 的巨噬细胞 + 外部注射 IgG;深蓝色为注射两次阻断 SIRPα且装载 IgG 的巨噬细胞
这个成绩可以说是很出色了,那么健康的人提供的巨噬细胞在改造后,应对人源小鼠肿瘤的能力又如何呢?研究人员再次进行了实验。同样是 3 天时间,肿瘤缩小了 20%,10 天后缩小了 40%!但是先别忙着惊喜,因为此时巨噬细胞的吞噬进入了“平台期”,即使额外注射 IgG 也没能让肿瘤继续缩小。
那该怎么办呢?研究人员在第 14 天时决定,再给小鼠们注射一次巨噬细胞!注射后,肿瘤果然继续减小了,最终肿瘤只有原来的 20% 大小,在 60 天内都没有出现再次生长。而且,阻断 SIRPα表达这一方法不像过去 CD47 抗体一样会伤害血细胞,在治疗的过程中,小鼠的红细胞、白细胞、血小板和血红蛋白的水平都保持在正常范围内,没有出现大幅度的下降,小鼠也没有出现严重的副作用。然而,肿瘤微环境中含有高水平的胶原纤维,胶原密度相对较大,因此实体瘤组织会呈现出“坚硬”状态,这与骨髓“柔软稀疏”的环境相差很大 [6]。而这种软硬程度的不同会改变细胞表型 [7],影响巨噬细胞的吞噬作用 [8]。因此,研究人员发现,这些改造过的巨噬细胞在肿瘤组织中生存一段时间后,会被“同化”为非吞噬性、高 SIRPα的巨噬细胞。当它们全部被同化后,肿瘤又恢复了正常的生长速度。
研究的第一作者 Cory Alvey 博士介绍说,临床试验的第一阶段就是测试疗法的安全性,从这些实验来看,他们认为这个方法进入临床是很有希望的。Discher 教授也表示,目前,他们主要希望在两个方面进行改进,一个是将疗法推及到其他的肿瘤模型中,看是否同样发挥作用,另外就是想办法尽可能延缓改造后的巨噬细胞被同化的速度 [9]。奇点糕设想着,未来或许有一种疗法,可以像现在治疗白血病时的骨髓捐献一样,将健康人的巨噬细胞改造后移植给癌症患者,帮助他们消灭实体瘤,抵抗癌症。
参考资料:
[1] Alvey C M, Spinler K R, Irianto J, et al. SIRPA-Inhibited, Marrow-Derived Macrophages Engorge, Accumulate, and Differentiate in Antibody-Targeted Regression of Solid Tumors[J]. Current Biology, 2017.
[2] Biswas S K, Mantovani A. Macrophage plasticity and interaction with lymphocyte subsets: cancer as a paradigm[J]. Nature immunology, 2010, 11(10): 889-896.
[3] Barclay A N, van den Berg T K. The interaction between signal regulatory protein alpha (SIRPα) and CD47: structure, function, and therapeutic target[J]. Annual review of immunology, 2014, 32: 25-50.
[4] Weiskopf, K., Ring, A.M., Ho, C.C.M., Volkmer, J.-P., Levin, A.M., Volkmer, A.K., Ozkan, E., Fernhoff, N.B., van de Rijn, M., Weissman, I.L., and Garcia, K.C. (2013). Engineered SIRPa variants as immunotherapeutic adjuvants to anticancer antibodies. Science 341, 88–91.
[5] Oldenborg, P.-A., Gresham, H.D., Chen, Y., Izui, S., and Lindberg, F.P. (2002). Lethal autoimmune hemolytic anemia in CD47-deficient nonobese diabetic (NOD) mice. Blood 99, 3500–3504.
[6] Egeblad, M., Rasch, M.G., and Weaver, V.M. (2010). Dynamic interplay between the collagen scaffold and tumor evolution. Curr. Opin. Cell Biol. 22, 697–706.
[7] Swift J, Ivanovska I L, Buxboim A, et al. Nuclear lamin-A scales with tissue stiffness and enhances matrix-directed differentiation[J]. Science, 2013, 341(6149): 1240104.
[8] Patel, N.R., Bole, M., Chen, C., Hardin, C.C., Kho, A.T., Mih, J., Deng, L., Butler, J., Tschumperlin, D., Fredberg, J.J., et al. (2012). Cell elasticity determines macrophage function. PLoS ONE 7, e41024.
[9] https://news.upenn.edu/news/penn-researchers-engineer-macrophages-engulf-cancer-cells-solid-tumors
扫描上面二维码在移动端打开阅读





