7 月 27 日,阿斯利康公布了 FLAURA、MYSTIC 这两项万人瞩目的 III 期研究的结果,一喜一忧,简单概述如下:FLAURA 研究成功,支撑奥西替尼 $30 亿 + 销售峰值预期。Tagrisso 是阿斯利康管线中最耀眼的明星产品,作为其他 EGFR 抑制剂治疗耐药后的二线或三线用药在 2015/11/13 获 FDA 批准上市,2016 年取得了 4.23 亿美元的成绩。FLAURA 研究在 556 例局部晚期或转移性 NSCLC 患者中证明 Tagrisso 作为一线疗法相比厄洛替尼、吉非替尼可带来具有临床意义的 PFS 显著改善。分析师对 Tagrisso 给出 30 亿 + 美元的销售峰值预期也是建立在 Tagrisso 可以获批成为 EGFR 突变 NSCLC 患者的一线疗法之上,因此 FLAURA 研究取得成功的结果并不意外。MYSTIC 研究错失主要终点,AZ 市值缩水 $125 亿。PD-1/PD-L1 市场竞争激烈,Imfinzi(durvalumab)是第 5 个上市的 PD-1/PD-L1 药物,时间和适应症都不占有优势。但肺癌是患者最多的肿瘤市场,durvalumab + tremelimumab(PD-L1+CTLA4)的组合一直被阿斯利康寄予厚望。如今 MYSTIC 研究初步结果显示 durvalumab + tremelimumab 作为一线疗法相比 SoC 对患者的 PFS 没有明显改善,这对阿斯利康是个不小的打击,因此昨日美股开盘阿斯利康股价也大跌 15% 以上,以 14.9% 的跌幅收盘,市值缩水 125 亿美元。阿斯利康昨天还公布了一份“无惊喜、有惊吓”的 2017H1 半年业绩报告,上半年总收入 104.56 亿美元,相比 2016 年同期的 117.18 亿美元下降了 11%。
从几个关键产品来看,Tagrisso 贡献 4.03 亿美元成最大亮点;Imfinzi 今年 5 月 1 日获批,上市 2 个月时间,在二线治疗尿路上皮癌这个适应症上仅抢到 100 万美元的份额,略显黯淡。Crestor 和 Seroquel XR 两个重磅炸弹在美国市场专利保护到期后,受到仿制药的冲击,上半年收入分别为 11.91 和 1.62 亿美元,相比 2016 年同期分别下降 43% 和 62%,拖累 AZ 整体表现。
阿斯利康 2017H1 主要产品销售额(亿美元)
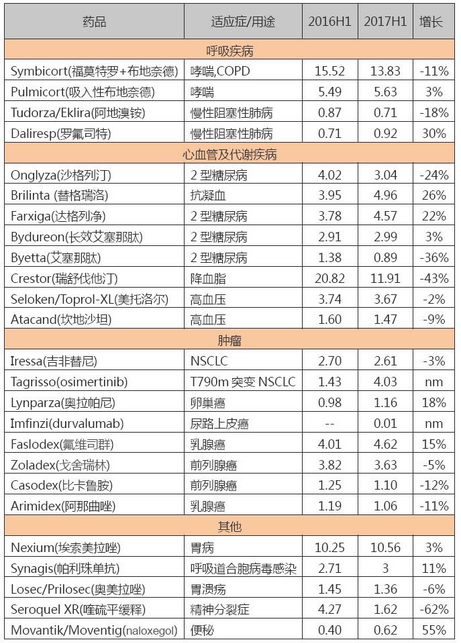
阿斯利康各疾病领域业务在 2017H1 的表现基本上延续了 2016 年的势头(见:阿斯利康 2016 财报 | 中国市场贡献 $26 亿成最强支撑),心血管 & 代谢、呼吸产品因为受到重磅产品专利到期和美国打击高药价的影响而出现下滑(中国等新兴市场一枝独秀),肿瘤产品成为最大的业绩增长动力。
阿斯利康近两年的发展策略是剥离非核心业务产品,把重心放在肿瘤免疫疗法上,所以不断传来阿斯利康转让产品权益的新闻,甚至连最热卖肿瘤药戈舍瑞林的美国权益也卖掉了(见:阿斯利康甩卖最畅销肿瘤药戈舍瑞林 专注肿瘤免疫疗法)。不过新药开发充满未知,ZS- 9 申报连连失利,阿斯利康在 PD-1/PD-L1 的竞赛中几乎没有占到任何便宜,AZ 目前的产品表现并不足以帮助 Pascal Soriot 兑现当初向股东承诺的 2023 年收入 $450 亿的目标。
刚刚从离职流言漩涡中走出来的 Pascal Soriot 因此也采取了进一步的行动。7 月 27 日,阿斯利康同时还宣布与默沙东达成一项肿瘤领域的全球战略合作,其中包括与默沙东联合开发和商业推广 Lynparza(奥拉帕尼,PARP 抑制剂)、selumetinib(MEK 抑制剂)单药或者联合 Imfinzi、Keytruda 用于多种肿瘤适应症。
根据协议,阿斯利康与默沙东将共同承担奥拉帕尼、selumetinib 单独使用或者与非 PD-1/PD-L1 药物联合使用的研发和商业推广成本,平分奥拉帕尼、selumetinib 单药或组合疗法的销售收入。此外,默沙东负责承担 Keytruda 与奥拉帕尼或 selumetinib 联用的所有开发及商业推广成本,阿斯利康负责承担 Imfinzi 与奥拉帕尼或 selumetinib 联用的所有开发及商业推广成本。通过此次合作,阿斯利康可从默沙东获得最高 85 亿美元付款,包括 16 亿美元预付款,7.50 亿美元权利许可费用以及 61.5 亿美元的注册和销售里程金。
此次与默沙东合作至少透露了阿斯利康发展战略上的以下两个信号:1)肿瘤免疫疗法仍是阿斯利康未来开发的重中之重。2)奥拉帕尼在公司产品管线中的战略地位显著提升。至少 Pascal Soriot 已经表述未来希望把奥拉帕尼打造成肿瘤免疫组合疗法的核心药物。
Lynparza 上市 2 年后的年销售额只有 2.18 亿美元,如果考虑到其是作为卵巢癌患者的四线用药,这个结果还算不错。Lynparza 目前的开发计划包括:阿斯利康已经在 EU、日本提交了 Lynparza 二线治疗卵巢癌的上市申请,2018H1 会获得审批结论。计划 2017H2 向 FDA 提交 Lynparza 二线治疗卵巢癌的上市申请。计划 2017H2 向 FDA 提交 Lynparza 治疗乳腺癌的上市申请。2018H1 获得 Lynparza 一线治疗卵巢癌的临床数据,并提交上市申请。其实纵观阿斯利康的新产品,替格瑞洛市场吸收略慢,达格列净的竞争环境比较恶劣,AZD9291 做到 EGFR+NSCLC 一线就算见顶,durvalumab 已经落后对手不止一点,而且还在 NSCLC 一线治疗上传来失败的消息……如今 PARP 这个靶点风头正盛(见:还在迷恋 PD- 1 和 CAR-T?阿斯利康已坐上下一个肿瘤药风口!),奥拉帕尼又是该靶点的 first in class 新药,已经在真实世界中接受了 2 年多的考验,确实是 AZ 目前最有想象空间的一个产品。至于 Lynparza 能不能给阿斯利康带来惊喜,大家就边走边看吧。
扫描上面二维码在移动端打开阅读





