要说近年来癌症领域取得的最大突破,那莫过于免疫疗法了。一些原本等同于死刑判决的恶性癌症,在免疫疗法的作用下,竟能连续 10 多年不复发,这近乎达到了治愈的效果,堪称奇迹。

但免疫疗法也不是万能的。肿瘤细胞一直在快速突变,而有些突变会让免疫疗法失效。目前我们知道,B2M、JAK1 与 JAK2 基因一旦发生突变失活,就会让免疫疗法失去应有的作用。
有趣的是,大自然有其“相生相克”的原理。一方面,肿瘤的突变可能会让免疫疗法失效;另一方面,肿瘤的突变,却能产生新的抗原,诱发免疫系统的攻击,提高免疫疗法的效果。因此,了解哪些基因突变可能会影响免疫疗法的效果(无论是提高还是抑制),对免疫疗法的开发非常重要。

▲我们找到了癌症免疫疗法的关键基因(图片来源:《自然》)
先前,CRISPR-Cas9 基因组编辑技术已被用于筛选潜在的基因靶点。在癌症细胞中,通过筛选,我们能找到影响癌细胞增殖、产生耐药性、诱使转移的基因。一些科学家们就想到,我们应该可以用同样的技术,筛选出会影响免疫疗法的基因。
今天在线发表的一篇《自然》论文中,一群科学家们就找到了一个会影响免疫疗法的关键基因。本研究由美国国立卫生研究院(NIH)的 Nicholas Restifo 教授主导,著名华人学者,CRISPR 技术先驱张锋教授协助参与。

在这项研究中,科学家们开发了一种全新的“双细胞 CRISPR”方法。该体系由人类的 T 细胞与黑色素瘤细胞组成。在癌症免疫疗法中,T 细胞需要直接对癌细胞进行杀伤,因此两者间的结合非常重要。按科学家们的设想,如果某个基因突变会影响这两类细胞的结合,就说明它对免疫疗法很重要。
于是,科学家们建立了一个大型的筛选库,里面带有超过 12 万个 sgRNA。这些 sgRNA 能靶向细胞内 19050 个编码蛋白质的基因,以及 1864 条微 RNA。平均下来,每个基因上会被分配到 6 条 sgRNA,每条微 RNA 上会被分配到 4 条 sgRNA。这些 sgRNA 会帮助 CRISPR-Cas9 系统对这些基因或微 RNA 进行敲除,揭露出它们在免疫疗法中的作用。
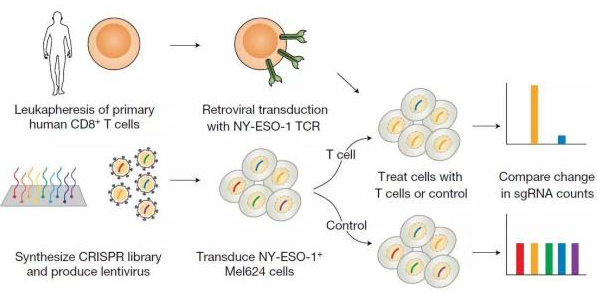
▲“双细胞 CRISPR”的设计(图片来源:《自然》)
科学家们发现,他们筛选出的基因,大部分与抗原递呈以及干扰素 -γ的信号通路有关,这表明这些基因有望成为未来研究的重点。其中,科学家们对一个叫做 APLNR 的基因产生了兴趣。这个基因的多个突变都会影响到免疫疗法的效果,这一点也在不同的癌症细胞系中得到了证实。因此,它参与的信号通路,对于癌症免疫疗法的开发,有着直接的应用价值。
那么,APLNR 基因究竟有啥作用呢?功能分析表明,它编码了一个 G 蛋白偶联受体。在许多癌症中,人们都观察到了它的突变。利用 RNA 测序的手段,科学家们在敲除了 APLNR 基因的细胞中分析了转录组,但与抗原递呈有关的 mRNA 转录水平没有发生明显变化。这表明 APLNR 可能是通过蛋白质的直接作用,影响了免疫疗法的效果。
在先前的数据库里,科学家们找到了线索。之前的一些数据表明 APLNR 可能会与 JAK1 蛋白结合,而我们知道 JAK1 蛋白会影响到免疫疗法。通过免疫沉淀实验,这一假设得到了验证。基于这些结果,科学家们提出了一个新机制:APLNR 蛋白能结合 JAK1,从而调节肿瘤对干扰素 -γ的响应。如果它失去功能,就会降低免疫疗法的效果。与之相对应,如果过量表达 APLNR,就能显著增强肿瘤细胞对 T 细胞攻击的敏感度。肿瘤细胞的细胞溶解率也从 71.7% 上升到了 81.1%。换句话说,肿瘤免疫疗法的效果有望得到提高。
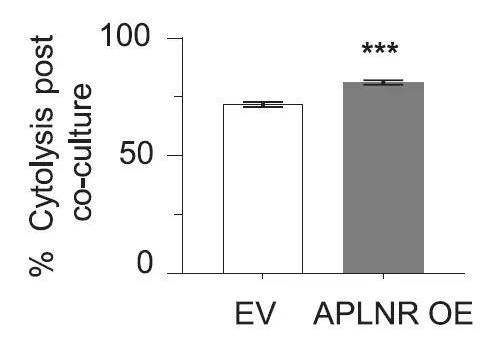
▲过量表达 APLNR,让肿瘤细胞溶解的更多(图片来源:《自然》)
总结来说,我们用 CRISPR-Cas9 基因编辑技术,筛选出了一个关键的基因 APLNR。它的突变会导致免疫疗法的效果下降。科学家们相信,这不但为我们提供了一个潜在增强免疫疗法的新靶点,还表明 CRISPR-Cas9 系统有望能用于寻找个体化的基因突变,加速个体化的新药开发。
也许不久后,每名癌症患者都能迎来最适合自己,也最有效的免疫疗法。我们期待这一天尽早到来!
参考资料:[1] Identification of essential genes for cancer immunotherapy
扫描上面二维码在移动端打开阅读





