2017 年 8 月 30 日,免疫治疗邻域迎来了一条重磅新闻。当天早上诺华宣布,美国 FDA 已经批准其突破性 CAR- T 疗法 Kymriah,治疗罹患 B 细胞前体急性淋巴性白血病(ALL),且病情难治,或出现二次及以上复发的 25 岁以下患者。这是人类历史上批准的首款 CAR- T 疗法,也是在美国境内,FDA 批准的首款基因疗法(1)。
无可否认,CAR- T 的出现,给濒临死亡的 ALL 患者带来了生存希望。毕竟即使对于无药可用的晚期 ALL 患者,CAR- T 也能取得 90% 的完全缓解率,这是以往任何一种治疗方案都无法达到的(2)。但是其严重的副作用也不能被忽略。
事实上,从 1993 年到现在已经 20 多年了,CAR- T 也已经由低效的第一代(3),发展到现在效果非常好的三代和四代(4)。不过,虽然三四代 CAR- T 效果更好,但是目前临床上使用的 CAR- T 仍旧是二代。这是因为,人们目前尚无法避免 CAR- T 的副作用,例如“细胞因子风暴”(5)。三四代的抗癌效果虽然更好,但是副作用也越大。二代 CAR- T 的副作用几乎已经是人类可以接受的极限了。
而现在,来自瑞士巴塞尔大学生物工程学院的细胞工程大牛 Martin Fussenegger 教授,首次成功的将非免疫细胞改造成了一种可以特异性靶向并杀死肿瘤细胞的“人造 CAR-T”,在成功避免了 CAR- T 的副作用的同时,还显著提高了治疗效率。不仅如此,这一方案理论上适用范围或许会超过 CAR-T。这一发现发表在权威杂志《自然化学生物学》杂志上(6)。
Fussenegger 教授,瑞士工程科学院(SATW),EMBO 和美国国家工程院(NAE)院士
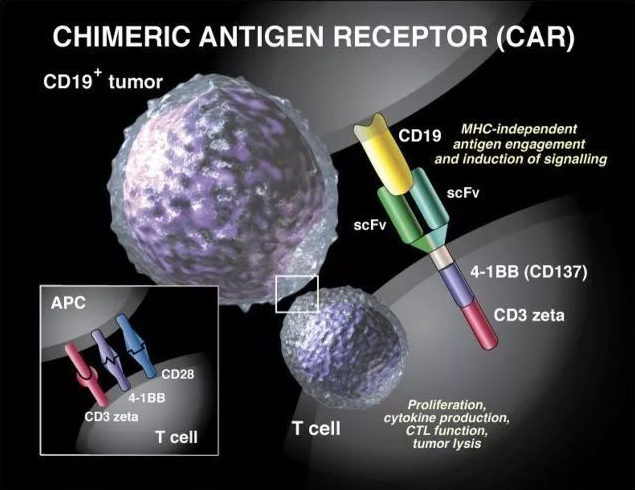
CAR- T 细胞治疗,简单说就是通过外源性的人工设计的嵌合抗原受体(CAR)基因导入 T 细胞内进行基因修饰改造后得到的表达 CAR 的 T 细胞(7)。CAR 上主要包括一个细胞外的肿瘤相关抗原结合区,以及一个细胞内信号区。当 CAR 上的抗原结合区与肿瘤细胞抗原结合后,就会激活细胞内的信号区,引起 T 细胞活化,从而释放大量的细胞因子对肿瘤进行攻击。
但是,由于 T 细胞在有杀灭癌细胞时释放了大量的细胞因子,诱发“细胞因子风暴”,因此也就不可避免地会引发全身性的免疫反应,导致正常的器官和组织被攻击。而“细胞因子风暴”最终会导致器官衰竭甚至死亡。这也是 CAR- T 目前在临床使用中面临地最大的问题(5)。而三代四代 CAR- T 抗癌效果更好,就是因为释放地细胞因子更多,因此其造成的自然副作用也就更大。
同时,CAR- T 在治疗癌症地过程中还有一个严重缺陷,就是 CAR- T 的效率非常低。因为目前 CAR- T 起效,还十分依赖 T 细胞与癌细胞之间地随机碰撞(8)。因此,目前基于 CAR- T 的治疗方案只限于几种特定的血液肿瘤。

Fussenegger 教授长期致力于哺乳动物地细胞工程改造。在 Fussenegger 教授看来,由于 T 细胞杀灭癌细胞需要用到细胞因子,而细胞因子的副作用目前来说又时无可避免地。因此,解决 CAR- T 这些缺陷地目前唯一可行的一个方法就是人工改造“有潜力”的非免疫细胞,通过特异性释放其他的抗癌物质杀灭癌细胞。
为此,Fussenegger 教授选择了两种常用的“有潜力”的非免疫细胞,间质干细胞和神经干细胞。这两种细胞具有先天性的靶向肿瘤细胞的能力,能在肿瘤细胞释放的某些物质的诱导下,自动“寻找”肿瘤细胞(9)。
但是,由于 T 细胞与非免疫细胞不同,适用于 T 细胞的那一套改造方法并不适合非免疫细胞。因此 Fussenegger 教授不得不选择自己重新设计了一套更加精密复杂的改造方案。
与 CAR- T 中仅仅插入 CAR 相比,Fussenegger 教授对非免疫细胞的改造主要也分为与 CAR 不同的三个部分。一是可以识别肿瘤特异性抗原的受体,二是一个全新的细胞内信号传导通路,激活后可以表达抗癌物质,三是一个接触性分子开关,负责控制细胞内信号通路的激活或关闭。
而当改造好的非免疫细胞进入机体后,这些细胞会主动寻找癌细胞,与癌细胞表面的特异性抗原结合,随后引发多米洛骨牌效应,打开分子开关,激活细胞内一系列的信号通路,产生抗癌活性物质,通过二者的接触面选择性的将抗癌活性物质注入癌细胞内,诱导癌细胞的凋亡。
由于,改造非免疫细胞的三个部分都是可以人工设计的。这也意味着,理论上,Fussenegger 教授可以选择任意类型癌细胞作为目标,以及让其释放任何抗癌物质,再加上非免疫细胞可以自动靶向肿瘤组织,这一方案所适用的范围或许会超过 CAR-T。

改造后的非免疫细胞(左),CD43-CD45 为 分子开关,右边为结合癌细胞后的状态
最后,Fussenegger 教授在乳腺癌中测试了人造非免疫细胞的效果。通过将干细胞进行结构改造,使其具有识别乳腺癌细胞表面的 HER- 2 抗原能力,并能产生一种复合结构的蛋白质。这种蛋白质由两部分组成,前面是一个“子弹”形状的可以轻松穿透细胞膜的蛋白质,尾部结合着可以激活抗癌药物的酶。
试验中,无活性的抗癌药物首先所有细胞摄入,包括正常细胞以及癌细胞。不过当加入人工改造后的非免疫细胞时,人工改造后的非免疫细胞可以自动靶向乳腺癌细胞,特异性地将这种酶注入乳腺癌细胞内,激活癌细胞内地抗癌药物,介导乳腺癌细胞的调亡。但其并不会影响周围的正常细胞的生存。这意味着,人工改造非免疫细胞用来抗癌的确是可行的。
下一步,Fussenegger 教授将会进行临床前研究以及临床研究,进一步确定这一方案的可行性。或许有一天,改造非免疫细胞将会为那些难以实施 CAR- T 治疗的患者,提供一种新型“免疫治疗“方案。
参考资料:
1.http://www.sciencealert.com/an-exciting-new-cancer-treatment-has-just-been-endorsed-by-fda
2.Maude S L, Frey N, Shaw P A, et al. Chimeric antigen receptor T cells for sustained remissions in leukemia[J]. New England Journal of Medicine, 2014, 371(16): 1507-1517.
3.Eshhar Z, Waks T, Gross G, et al. Specific activation and targeting of cytotoxic lymphocytes through chimeric single chains consisting of antibody-binding domains and the gamma or zeta subunits of the immunoglobulin and T-cell receptors[J]. Proceedings of the National Academy of Sciences, 1993, 90(2): 720-724.
4.Wang J, Jensen M, Lin Y, et al. Optimizing adoptive polyclonal T cell immunotherapy of lymphomas, using a chimeric T cell receptor possessing CD28 and CD137 costimulatory domains[J]. Human gene therapy, 2007, 18(8): 712-725.
5.Bonifant C L, Jackson H J, Brentjens R J, et al. Toxicity and management in CAR T-cell therapy[J]. Molecular Therapy—Oncolytics, 2016, 3.
6.Kojima R, Scheller L, Fussenegger M. Nonimmune cells equipped with T-cell-receptor-like signaling for cancer cell ablation[J]. Nature Chemical Biology, 2017: nchembio. 2498.
7.Fesnak A D, June C H, Levine B L. Engineered T cells: the promise and challenges of cancer immunotherapy[J]. Nature Reviews Cancer, 2016, 16(9): 566-581.
8.Zhang H, Ye Z, Yuan Z, et al. New strategies for the treatment of solid tumors with CAR-T cells[J]. International journal of biological sciences, 2016, 12(6): 718.
9.Li L, Guan Y, Liu H, et al. Silica nanorattle–doxorubicin-anchored mesenchymal stem cells for tumor-tropic therapy[J]. ACS nano, 2011, 5(9): 7462-7470.
扫描上面二维码在移动端打开阅读





