癌症一直是人类需要面临的重大问题,之前人们更多的把癌症诊断书看作死亡通知书。当6岁的小女孩Emily被诊断为淋巴瘤时,她的家人是绝望的。但科学家似乎并不想让Emily离开家人的怀抱,大胆地使用了一种前所未有的治疗方法。奇迹真的发生了,当Emily在7岁生日睁开眼的那一时,似乎是宣告人类能够战胜肿瘤的那一刻。那么是什么样的治疗方法能够起到这种起死回生的效果呢?没错,就是近期如火如荼发展中的肿瘤免疫治疗:CAR-T(Chimeric Antigen Receptor T-Cell, T细胞嵌合抗原受体)。CAR-T作为一种免疫细胞治疗方案,更是吸引了越来越多研究者和投资人的大量关注。现在,笔者就给大家系统梳洗一下,CAR-T具体是什么?它是怎么来治疗肿瘤的?它有副作用吗?它的市场前景如何?
01
CAR-T的原理解读
想要了解CAR-T,我们得首先聊聊普通T细胞在免疫系统是如何发挥作用的。在免疫系统中,T细胞能够直接杀死异常细胞,但得借助于抗原递呈细胞(APC)的帮助。APC表面有许多用于识别细胞表面抗原的MHC(主要组织相容性复合体)分子,等APC识别到异常细胞之后,MHC就会和T细胞受体(TCR)结合,把信号传递给T细胞。在CD3、CD4和CD8等分子的帮助下,T细胞才能最终识别异常细胞并将其杀死。但肿瘤细胞简直是“丧心病狂” ,它把自己的 “指纹” 给毁了,所以APC细胞就无法识别它。这时候我们的CAR-T就能派上用场了。
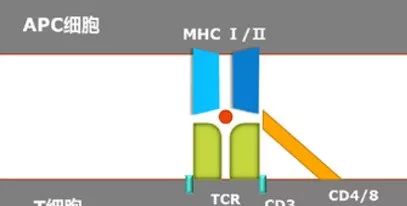
CAR-T是指将经过设计的T细胞在实验室中进行培养生长,达到数十亿之多后,再将扩增后的T细胞注入到患者体内,注入之后的T细胞也会在患者体内增殖,并杀死具有相应特异性抗原的肿瘤细胞。CAR-T的优势在于其识别肿瘤抗原是以HLA(人类白细胞抗原)非依赖的方式,这就使得经过CAR改造后的T细胞也能击杀HLA表达下调的肿瘤细胞。而且经CAR改造的T细胞相较于天然T细胞表面受体TCR能够识别更广泛的目标,因为CAR改造的T细胞可针对任何细胞表面抗原,包括蛋白/糖和糖脂激起的多克隆抗体。
并且,CAR能够让T细胞搭载多个T细胞激活信号,这可以改善T细胞的增殖/生存和杀死肿瘤细胞的能力。值得注意的是,能够加载的不仅仅是激活信号, T细胞还能加上那个潜在的抗癌免疫调节因子(如细胞因子),以在肿瘤微环境中增强抗肿瘤效果。
CAR-T的结合原理是抗原抗体结合机制。CAR的设计中包括四个部分:一个肿瘤相关抗原(tumor-associated antigen,TAA)结合区,一个胞外铰链区,一个跨膜区和一个胞内信号区。CAR的特异性、有效性乃至安全性主要取决于目标抗原的选择,而只在肿瘤细胞表达同时直接关系到肿瘤细胞的存活的抗原是理想抗原。
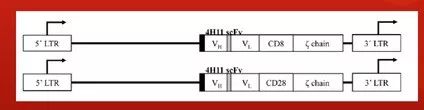
目前的明星抗原就是T细胞表达的CD19,这种抗原不但表达于所有正常的B细胞表面,也表达于多数恶性增殖的B细胞表面。使用抗CD19的CAR-T细胞进行治疗,最常运用在B细胞再生障碍性贫血上。 还有另外一些CAR-T的靶向分子,包括锚定ERRB2(HER-2/neu)治疗肺部和前列腺癌,锚定前列腺特异性抗原PSA治疗前列腺癌等等,这表明CAR-T细胞在抗肿瘤方面的广泛应用。
为了加强CAR激活信号,研究人员还在T细胞上加上了共刺激信号。第一个被详细研究的T细胞共刺激信号受体是CD28,它能够与靶细胞表面的B7家族成员结合。CD28的共刺激能够带来众多好处,包括促进T细胞的增殖、IL-2的合成表达、抗凋亡蛋白Bcl-xL的分泌,还能使改造后的T细胞抵消肿瘤细胞微环境带来的不利影响。
我们知道,想要根除疾病,T细胞需要迁移到肿瘤病灶区发挥作用。幸运的是,基础和临床试验均表明CAR-T细胞能够迁移到肿瘤周围这一点。基因改造后的T细胞能够表达次生CAR,从而定位于发病部位。为了更好的促进T细胞迁移,研究人员可以在CAR-T细胞中表达CXCR2(CXCL1受体)和CCR4(CCL17受体),改造基因以表达细胞因子受体入手。
锚定好肿瘤细胞后,消灭肿瘤还得依赖于CAR改造T细胞在过继后能够持续保持细胞毒性,能够裂解肿瘤细胞。虽然患者体内肿瘤微环境中的Treg细胞或者免疫抑制分子等会抑制外来和内源T细胞的抗肿瘤活性,但临床数据表明,利用CAR改造T细胞消除肿瘤仍然是目前最有效的抗肿瘤手段。CAR-T细胞保持细胞毒性的一个间接证据是“是靶向/非肿瘤”毒性的存在,比如锚定CD19分子而引起的低丙种球蛋白血症。促炎症细胞因子的增多,是另外一个过继后T细胞保持功能的标志。
当然,不可避免的,CAR-T也是一把双刃剑,其副作用是一个不能回避的问题。最主要的一个副作用是细胞因子风暴。由于T细胞在体内持续增殖,继而引起的大量细胞因子释放,导致患者出现发热、肌痛、低血压和呼吸衰竭等症状。这也是导致试验患者死亡的主要原因之一。另外一个副作用就是靶向非肿瘤细胞毒性。由于CAR-T抗原的靶向性非常强,无法区分表达相应抗原的肿瘤细胞和正常细胞,因此也会攻击表达相应抗原正常细胞,会大致比如导致B细胞发育不良等症状。CAR-T对神经系统也有一定的毒性,少数患者会出现神经错乱、语言障碍、癫痫等不良反应。
但必须强调的一点的是,由于CAR-T能够在相对较短的时间内产生大量有肿瘤杀伤效力的T细胞,从而使得这一技术在临床上应用比较广泛。随着一代代临床试验的开展,CAR-T已经成为癌症患者的救命天使。
02
CAR-T的技术改进
CAR-T细胞的持续性是目前研究的一个热门方向,毕竟,治疗的目的是为恶性肿瘤患者提供持久、理想的永久性缓解,尤其是对于实体瘤患者。
那么如何提高CAR-T细胞的持续性呢?讨论这个问题之前,先让我们回顾一下CAR-T是如何从第一代发展到第三代的。如图所示,CAR-T的基本结构包括:胞外靶标结合模块、跨膜结构域(TM结构域)和传递激活信号的胞内信号传导域(ICD)。而CAR-T的改进主要体现在ICD区域的变化。第一代是包括T细胞受体CD3ζ链,但临床试验中发现T细胞持久性不佳。于是科学家就加入了CD28或者4-1BB等共刺激蛋白,造就了第二代CAR-T。含有CD28或4-1BB共刺激结构域的CAR是迄今为止应用最广泛的,并且已经在临床试验中表现出了显著的反应,T细胞持久性得到改善。研究表明CD28细胞内结构域能够刺激更强的CAR-T细胞功能,而4-1BB细胞内结构域能够促进更强的CAR-T细胞持久性。但科学的发展永不止步,科学家在ICD中加入两个共刺激蛋白,于是第三代CAR-T横空出世。而今天谈及的主要是第三代CAR-T。

谈及到第三代CAR-T,我们就不得不致敬一下CAR-T元老级人物Carl June教授,这位将CAR-T带入大众视线的先驱者仍然奋战在CAR-T第一线,不断优化和改进CAR-T技术。2018年1月,权威学术期刊《JCI insight》发表了Carl June的最新改进方法:通过ICOS和4-1BB刺激能够增强CAR-T细胞的持久性。
在实验中,研究人员将表达不同CAR的CD4+ 和CD8+ T细胞以1:1混合注入到小鼠体内后,发现表达ICOS-CAR的CD4+ T细胞在增加自身持久性的同时,还能够提高共同注射到小鼠体内的CD8+ T细胞的持久性。接下来,科学家们就将ICOS和4-1BB都加入到了第三代CAR-T的胞内结构域(ICOSBBz-CAR),结果表明,当CD4+ 和CD8+ T细胞都表达ICOSBBz-CAR 时,这些T细胞不仅持久性得到了显著的提高,抗肿瘤疗效也达到了最佳水平[1]。
Carl June并不是孤独的斗士,就在他的工作发表1个月以后,多伦多大学医学院和日本的Takara Bio公司也开发了一种新的CAR-T技术,在CD19 CAR中加入白细胞介素-2受体β链(IL-2Rβ)、STAT3结合酪氨酸-XX-谷氨酰胺(YXXQ)基序、TCR信号(CD3ζ )和共刺激(CD28)结构域[以下简称28-ΔIL2RB-z(YXXQ)],这种新一代CAR-T细胞具备更持续有效的扩增能力以及抗癌活性,并且在人源癌症的免疫缺陷型小鼠体内对抗特定肿瘤的效果更好。相关研究结果公布在最新一期的《自然·医学》(Nature Medicine)上。这种新型CAR-T的优势在于STAT3转录因子(JAK激酶重要的调节因子)的作用,促进了体外T细胞的增殖能力,并防止成体终末分化。相比于传统的BB-z CAR- T细胞,28-ΔIL2RB-z(YXXQ)-T细胞对CD19+急性B淋巴细胞白血病细胞的疗效更佳,其在外周血中也表现出了更好的持久性[2]。
其他方面,还有利用反转细胞因子受体[3]或者纳米颗粒改进CAR-T的[4]。有兴趣的读者可以深入了解一下。
03
CAR-T的市场分析
毫无疑问,CAR-T的未来市场是巨大的。到目前为止,Kymriah和Yescarta这两款FDA授权的产品还远远不能满足市场的需求。据(Nat Rev Drug Discov)[5]预计,2026年血液恶性肿瘤药物市场规模最大的几类适应症依次是复发难治性非霍奇金淋巴瘤(包括弥漫大B细胞淋巴瘤、滤泡性淋巴瘤、套细胞淋巴瘤和慢性淋巴细胞白血病)和多发性骨髓瘤,销售额累计将超过200亿美元,其中CAR-T疗法约占11亿美元,主要是来自儿童和年轻成人急性淋巴细胞白血病患者(44%)及弥漫大B细胞淋巴瘤患者(46%)的治疗。Kymriah和Yescarta主要在套细胞淋巴瘤和滤泡性淋巴瘤方面具有先发优势。
值得提及的是, 基于CD19的CAR-T治疗预期在未来一段时间之内将主导全球CAR-T细胞治疗市场。CD19-CAR-T产品预计在2023年将达到十亿美元的里程碑。许多公司正在使用CD19-CAR-T治疗白血病,与此同时针对其它抗原的CAR-T疗法也预期将为实体瘤的治疗创造显著的收益机会。很多公司都在倾注全力来缩短产品上市时间,以便在接下来的10年中能够把握住这一巨大的市场机会。
不过,CAR-T细胞疗法的发展仍处于起步阶段,Kymriah和Yescarta的高昂定价间接提高了肿瘤治疗的价格上限,也让很多消费者望而却步。降低CAR-T的成本,也应该成为制药公司思考的问题之一。
04
CAR-T的副作用分析
副作用是CAR-T治疗方面不得不提及的一个问题。最让人头疼的就是细胞因子风暴(cytokine release syndrome, CRS),也是CAR-T 技术在临床应用中一个最主要的不良反应。由于T细胞大量增殖,导致细胞因子释放出来,引起机体出现发热或发烧,肌痛,低血压,呼吸衰竭等症状。这些不良反应便是CRS。Kymriah的上市无疑给众多病患带来了曙光,然而其劣根性在于,CAR-T治疗也会引起 CRS 这一不容忽视的副作用。

幸运的是,而针对CAR-T 细胞回输引起的细胞因子风暴,临床上可以利用IL-6受体拮抗药物进行治疗。市场上也有一些针对CRS的检测工具,可以及时监测到CRS的发生。
还有一个副作用是靶向细胞毒性。由于CAR-T抗原的靶向性非常强,无法区分表达相应抗原的肿瘤细胞和正常细胞,因此CAR-T都会攻击表达相应抗原的肿瘤细胞和正常细胞。比如,针对CD19的CAR-T细胞治疗,导致B细胞发育不良,靶向HER2的CAR-T细胞会导致其他组织或器官遭受攻击,如心肺系统毒性。这方面的解决办法就是设计针对性强的CAR,尽可能减少CAR-T损伤正常组织。