癌症免疫治疗应用研究已有将近130年的历史。
癌症免疫领域的先驱者、美国医生威廉·科利(William Coley)早在1893年就开始采用由化脓性链球菌制备的丹毒细菌毒素(后来被称为“科利毒素”或“科利疫苗”),反复接种给晚期癌症患者,刺激发热和机体产生免疫反应,使一些患者的肿瘤消退。
这项开创性早期工作首次提供了接种抗原性物质可能刺激人体免疫系统,达到临床上明显抑制肿瘤增长的直接证据。
此后,癌症免疫治疗经历了漫长艰辛的发展,科利本人和他的“疫苗”也经历过许多艰难的困境与挫折。
直到最近几年,癌症免疫治疗领域出现的两个里程碑式的进展:嵌合抗原受体T淋巴细胞(CAR-T)和免疫核查点信号阻断抗体PD-1/PD-L1的创新和临床应用,使癌症免疫治疗真正走上了台面,成为继手术、化疗、放疗和靶向治疗后又一种癌症治疗方法,并有希望成为癌症治疗的最重要手段。
治疗性癌症疫苗领域经过百年的积淀,最近也获得了重要进展。个体化新生抗原(neoantigen)癌症疫苗的开发和应用,成为癌症免疫治疗的又一条新途径。
癌症疫苗
近代癌症疫苗的研发也有几十年了。但是,迄今为止,仅有个别产品进入临床应用。例如人乳头状瘤病毒(HPV)疫苗,这种预防性癌症疫苗只是对与病毒感染相关的癌症具有疗效。

前列腺癌疫苗(Sipuleucel-T)是目前唯一得到美国食品药品监督管理局(FDA)批准进入临床应用的治疗性疫苗,实际上这种疫苗也只能达到边缘性的临床效果。
总体而言,与其他免疫疗法比较,尤其是PD-1和T细胞治疗,绝大多数治疗性癌症疫苗并没能证明具有显著的临床疗效。
以往,大多数癌症疫苗多使用肿瘤相关抗原(Tumor associated antigens,TAAs)作为免疫原。这些TAAs本质上是非突变的自身抗原(self-antigens),存在于正常基因组中。
TAAs通常在人体正常细胞中以相对低水平表达的状态存在,而在癌症组织中表现为过度表达。接种以TAAs为基础的癌症疫苗的目的,在于激发机体产生针对相应TAAs的免疫反应,主要是激活T细胞,杀灭和清除表达该TAAs抗原的癌细胞。
然而,TAAs疫苗作为机体正常存在的自身抗原,在临床应用上存在两个主要的问题。
-
首先,由于自身抗原在体内的存在可以造成免疫系统产生中枢性耐受(Central Tolerance)。换句话说,免疫系统不把这些自身抗原当作异物处理,因此,不产生强烈的抗肿瘤免疫反应。
-
其次,在某种条件下,如果诱发了针对TAAs的强烈免疫反应,有可能造成自身免疫(autoimmunity)异常。上述因素可能是导致TAAs自身抗原疫苗临床疗效不明显和出现不良反应的主要原因。因此,一些学者认为,选择和开发基于基因突变产生的癌症特异性抗原疫苗,可能是解决与TAAs有关的中枢耐受和自身免疫问题的重要途径。
新生抗原
癌症新生抗原是体细胞突变的产物。这些癌症特异性抗原可以来自病毒蛋白、基因翻译后的修饰或体细胞突变(如点突变、插入和缺失、开放阅读框架改变等)。
癌细胞中普遍存在的基因突变及其产物是健康细胞和正常基因组中所没有的,它们不仅是特异性癌症抗原,而且由于不存在中枢性耐受的基础环境,可能具有高度免疫原性,具备构建癌症疫苗的理想条件。
虽然对癌症新生抗原的认识由来已久,但是直到最近新一代基因测序技术的日益完善,才有可能对大量突变的新生抗原进行识别和鉴定。通过对癌组织全外显子基因测序,结合对人类白细胞抗原(HLA)表位结合亲和力的预测,能够对每个患者的候选癌症新生抗原进行鉴定、评估和选择。
逐渐增多的证据显示,以突变新生抗原为基础的个体化癌症疫苗具有重要的发展潜力。
新生抗原总体上也可以分为两类:共有的和独有的。共有的新生抗原是指某些类型癌症和不同患者间共同存在的突变抗原,而在正常基因组中并不存在。
免疫原性高的共有新生抗原有可能筛选用作广谱的治疗性癌症疫苗,用于那些有相同突变基因的患者。大多数新生抗原都是独特的突变抗原,在患者与患者之间、肿瘤与肿瘤之间是完全不同的。
因此,独有新生抗原制备的癌症疫苗只能特异性地、一对一地针对每个个体患者或肿瘤,从这种意义上来说,这是真正的、纯粹的个体化治疗。由于相同类型肿瘤的基因突变可以有广泛的不同,这就构成癌症个体化免疫治疗必要性的重要基础。个性化癌症疫苗方法也是确保使每个癌症患者产生抗肿瘤免疫反应的最佳方法。
疫苗制备
目前,个体化新生抗原癌症疫苗的制备过程已经逐渐系统化。其基本程序主要分3个阶段:收集患者的癌症组织和正常组织标本、新生抗原鉴定以及疫苗制备。
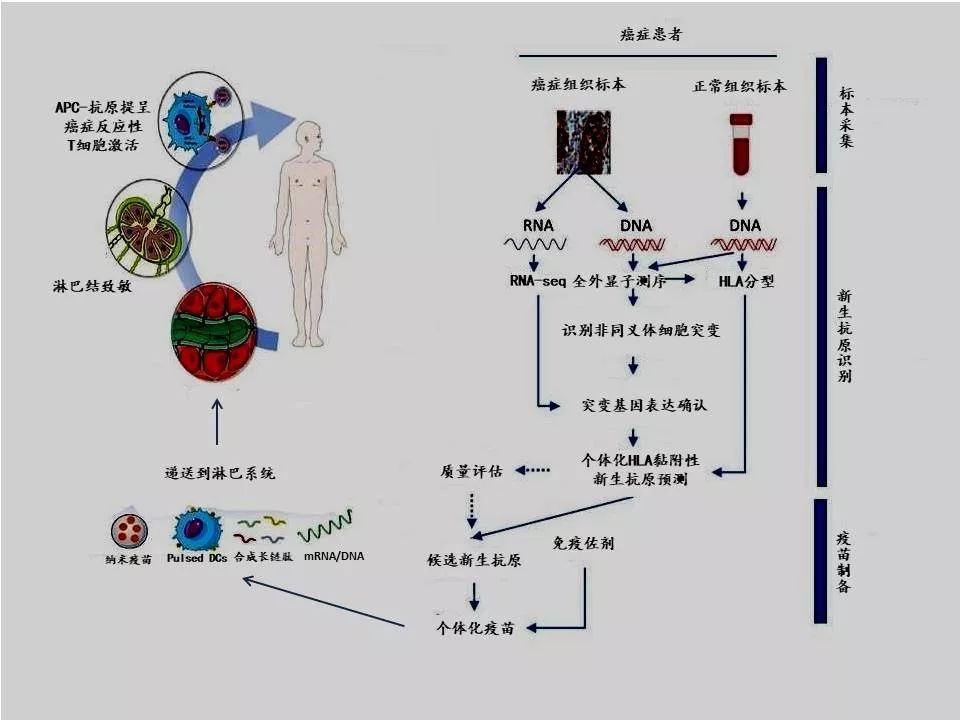
新生抗原鉴定,首先采用全外显子测序对比癌症和正常组织的基因序列,获得癌组织突变基因数据。利用突变基因编码的新生抗原作为疫苗,要求该抗原必须具有免疫原性,换句话说,选择的抗原接种后要能够引发机体产生抗癌免疫反应。
因此,新生抗原鉴定还要经过cDNA芯片或RNA序列(RNA-seq)检测,依照基因表达水平来选择合适的突变新生抗原。最后,采用生物信息学或人工智能算法,预测这些候选抗原与人类白细胞抗原(HLA)的黏附亲和力(Banding affinity),据此进一步将候选抗原排序并最终决定选用哪些新生抗原。
最后阶段是疫苗的制备和临床应用。癌症疫苗的制备有多种形式,如DNA/mRNA、合成的长链多肽、体外抗原冲击的树枝状细胞(Pulsed DCs)和生物材料辅助疫苗等。
不同类型的免疫佐剂也可以增强疫苗的免疫原性。疫苗制备工艺和免疫佐剂都是快速发展的专业领域,最终目的在于能够提高疫苗的免疫原性和疗效。
最后,将新生抗原疫苗有效递送至次级淋巴器官(如淋巴结),在那里被抗原提呈细胞(APC)捕获并呈递给CD8+或CD4+ T细胞等免疫效应细胞,最终产生有效的抗肿瘤免疫反应。
一些临床和实验研究显示,患者癌症新生抗原负荷量与肿瘤免疫反应发生和患者临床预后具有明显相关性。
研究也发现,如果肿瘤有较高的新生抗原,往往伴有较强的T细胞反应,患者则有更好的临床结果。一项对619例结直肠癌研究的资料显示,那些有高频率突变新生抗原的患者,往往伴有增高数量的肿瘤浸润淋巴细胞(Tumor Infiltration Lymphocytes,TILs),而且获得存活率的改善。
在有效的抗肿瘤免疫治疗中,如使用PD-1、CTLA-4或TILs治疗的患者,常常发现有新生抗原特异性T细胞群体的扩增。此外,体外实验显示,人和动物的新生抗原特异性T细胞能直接杀伤表达突变抗原的肿瘤细胞,并在动物模型中能完全抑制肿瘤生长或导致肿瘤缩小。
临床应用
有关癌症新生抗原疫苗的临床应用,最近有两项早期工作的报道。
美国波士顿达纳-法伯癌症研究所(DFCI)使用合成的长链新生抗原多肽,以Poly IC:LC为免疫佐剂制备疫苗治疗黑色素瘤患者。每例疫苗包含多达20条预测的个体化新生抗原多肽,临床试验结果证明,该疫苗使用具有可行性、安全性和免疫原性。
疫苗诱导产生多功能CD4+和CD8+ T细胞,在患者间使用的97条独有新生抗原中,CD4+ T细胞能识别58条(占60%), CD8+ T细胞能识别 15条(占16%)。
这些T细胞能够对突变抗原和野生型抗原加以区别,并且在某些情况下能直接识别杀死自体肿瘤细胞。6名患者中,4名在接种疫苗后25个月仍未复发,而2名复发患者随后接受PD-1药物治疗,复发肿瘤完全消退,并出现新生抗原特异性T细胞的扩增。
这些资料为深入开发个体化疫苗技术,无论是单独接种,还是联合PD-1或与其他免疫疗法联合使用,提供了有力证据。
德国研究人员采用RNA为基础的新生抗原疫苗治疗晚期黑色素瘤。合成的mRNA 编码多个新生抗原决定簇(poly-neoepitopes),经淋巴结接种疫苗。免疫接种后,在所有治疗的13例患者中均成功诱导了针对多种新生抗原的有效T细胞应答。
与达纳-法伯癌症研究所的结果类似,尽管预测选择的多为高亲和力的HLA-I型新生抗原,但大多数新生抗原诱发的是HLA-II型限制性CD4+ T细胞的应答反应。免疫后随访期,8例患者仍处于无肿瘤复发状态(接种后12~24个月)。
5例复发患者中,1例病情进展后,采用PD-1治疗获得完全缓解;1例后期复发患者对疫苗和PD-1治疗均无反应,最终死亡,复发肿瘤标本检查分析显示,该患者β2微球蛋白等位基因均出现缺失,可能是导致后期对免疫治疗缺乏反应的原因;其余3例患者,均有程度不同的针对新生抗原的免疫反应存在。这些结果也证明mRNA新生抗原个体化癌症疫苗同样具有重要的发展潜力。
重重挑战
像许多新概念刚刚出现一样,学界往往存在不同的观点和评价。许多学者认为,突变新生抗原个体化癌症疫苗是继CAR-T和PD-1之后,肿瘤免疫治疗又一个里程碑式的进展。
也有学者认为,新生抗原是很早就有的名词,以往包括病毒和原癌基因编码的非突变型新生抗原,由于现在概念限定于随机突变基因,使之引起越来越多的特别关注。
这些学者也认为,突变型新生抗原是否比非突变型新生抗原更具有免疫原性,还需要大量工作加以证实。虽然突变型新生抗原概念出现和作为个体化免疫治疗新方式迅速进入临床试验,但是其制作工艺属于劳动密集型个人定制的方式,目前可能是一种昂贵的疗法。
因此,在疫苗开发中没必要去竞争,或取代那些传统研发的基于非突变共有新生抗原的癌症疫苗,后者是可以广泛适用、现成产品、具有成本效益、价格便宜的非个体化癌症疫苗。
目前,在大量突变新生抗原中筛选有明显疗效的片段仍然是难度较高的工作。此外,如何对付疫苗接种后癌细胞出现的新型突变导致的抗原逃逸,以及如何保证所有癌细胞都存在疫苗选择的特异性突变,以避免免疫逃逸,都可能是新生抗原疫苗将要面对的挑战。
从科利开始的癌症免疫治疗到现在已是百年变迁,CAR-T、PD-1乃至个体化突变新生抗原癌症疫苗的出现,终于迎来了癌症免疫治疗的春天。
考虑到CAR-T在实体肿瘤中面临的瓶颈和PD-1药物只在大约20%的癌症患者中有持久疗效,当今癌症免疫的机理许多还不十分清楚。因此,癌症免疫治疗的春天只是刚刚开始。
参考文献:
1. Coley, W B. The treatment of malignant tumors by repeated inoculations of erysipelas. With a report of ten original cases. 1893. Clin Orthop Relat Res 1991, 262, 3–11
2. Coley,W B. The Treatment of Malignant Disease by the Injection of Toxins of Erysipelas. Br Med J. 1897, 1(1888): 625
3. Yarchoan M, Johnson BA, Lutz ER, Laheru DA, Jaffee EM. Targeting neoantigens to augment antitumour immunity. Nat Rev Cancer 2017, 17:209–22.
4. 阎影.治疗前列腺癌的癌症疫苗(Sipuleucel-T). 新浪博客http://blog.sina.com.cn/s/blog_8079e9f50102v710.html
5. Fritsch EF, Rajasagi M, Ott PA, Brusic V, Hacohen N and Wu CJ et al. HLA-binding properties of tumor neoepitopes in humans. Cancer Immunol Res. 2014,2, 522–529.
6. Hu Z, Ott P A, Wu CJ. Towards personalized, tumour-specific, therapeutic vaccines for cancer. Nature Rev Immunol. 2018,18:168-182
7. Capietto AH, Jhunjhunwala S, Delamarre L. Characterizing neoantigens for personalized cancer immunotherapy. Curr Opin Immunol. 2017,46:58–65.
8. Schumacher TN, Schreiber RD. Neoantigens in cancer immunotherapy. Science. 2015,348:69–74.
9. Giannakis M, Mu X J, Shukla SA, et al. Genomic correlates of immune-cell infiltrates in colorectal carcinoma. Cell Res. 2016, 15:857–865.
10. van Rooij N, van Buuren MM, Philips D, et al. Tumor exome analysis reveals neoantigen- specific Tcell reactivity in an ipilimumab responsive melanoma. J Clin Oncol. 2013, 31:e439–e442.
11. Tran, Ahmadzadeh M, Lu YC, Gros A. et al. Immunogenicity of somatic mutations in human gastrointestinal cancers. Science 2015, 350:1387–1390.
12. Matsushita H, Vesely MD, Koboldt DC. et al. Cancer exome analysis reveals a Tcell- dependent mechanism of cancer immunoediting. Nature 2012,482: 400–404 .
13. Ott PA, Hu Z, Keskin DB, Shukla SA, Sun J. et al. An immunogenic personal neoantigen vaccine for patients with melanoma. Nature 2017, 547 (7662):217-221
14. Sahin U, Derhovanessian E, Miller M, et al. Personalized RNA mutanome vaccines mobilize poly-specific therapeutic immunity against cancer. Nature. 2017, 547:222–6.
15. Finn OJ and Hans-Georg Rammensee H-G. Is It Possible to Develop Cancer Vaccines to Neoantigens, What Are the Major Challenges, and How Can These Be Overcome? Neoantigens: Nothing New in Spite of the Name. Cold Spring Harb Perspect Biol 2018;10:a028829.