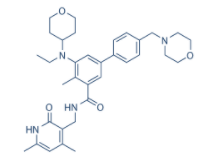
他泽司他详细说明书
【处方药】:是
【包装规格】:200毫克/片 240片/瓶
【计价单位】:瓶
【生产厂家】:Epizyme, Inc
【商品名】:Tazverik
【药品名】:tazemetostat
【Tazverik作用机理】
1.Tazemetostat是甲基转移酶EZH2和一些EZH2功能获得性突变的抑制剂,包括Y646X,A682G和A692V。Tazemetostat还以392 nM的一半最大抑制浓度(IC50)抑制EZH1,约为抑制EZH2的IC50的36倍。
2.EZH2最有特色的功能是作为多梳抑制复合物2(PRC2)的催化亚基,催化组蛋白H3的赖氨酸27的单,二和三甲基化。组蛋白H3的三甲基化导致转录抑制。
3.SWItch/蔗糖不可发酵(SWI/SNF)复合物可拮抗PRC2在上皮样肉瘤患者某些基因表达的调节中的功能。某些SWI/SNF复杂成员(例如整合酶相互作用子1[INI1/SNF5/SMARCB1/BAF47],SMARCA4和SMARCA2)丧失或功能异常的临床前体外和体内模型可导致异常的EZH2活性或表达并导致致癌对EZH2的依赖。
4.Tazemetostat在体外抑制B细胞淋巴瘤细胞系的增殖,并在具有或不具有EZH2功能获得性突变的B细胞淋巴瘤的小鼠异种移植模型中显示出抗肿瘤活性。
5.Tazemetostat证明对具有突变EZH2的淋巴瘤细胞系增殖的抑制作用更大。
【Tazverik适应症和用途】
TAZVERIK是一种甲基转移酶抑制剂,可用于治疗:
1.16岁及以上患有转移性或局部晚期上皮样肉瘤的成人和儿科患者不符合完全切除的条件
2.成人复发或难治性滤泡性淋巴瘤患者,其肿瘤经美国食品药品管理局(FDA)批准的检测为EZH2突变阳性,并且至少接受过2种先前的全身疗法。
3.成人复发或难治性滤泡性淋巴瘤患者,没有令人满意的替代治疗选择。
这些指示根据总体响应率和响应时间在加速批准下获得批准。这些适应症的持续批准可能取决于验证试验中对临床益处的验证和描述。
【Tazverik剂量和给药】
建议的剂量为800毫克,每天口服两次,带或不带食物。
剂量形式和强度
片:200毫克
【Tazverik警告和注意事项】
1.继发性恶性肿瘤:TAZVERIK增加了发生继发性恶性肿瘤的风险,包括T细胞淋巴母细胞淋巴瘤,骨髓增生异常综合症和急性髓细胞性白血病。长期监测患者的继发性恶性肿瘤的发展。
2.胚胎-胎儿毒性:可引起胎儿伤害。建议患者有胎儿潜在危险,并使用有效的非激素避孕方法。
【Tazverik不良反应】
1.上皮样肉瘤患者最常见的不良反应(≥20%)为疼痛,疲劳,恶心,食欲下降,呕吐和便秘。
2.滤泡性淋巴瘤患者最常见的不良反应(≥20%)是疲劳,上呼吸道感染,肌肉骨骼痛,恶心和腹痛。
【Tazverik药物相互作用】
1.强和中度细胞色素P450(CYP)3A抑制剂:避免将强和中度CYP3A抑制剂与TAZVERIK并用。
如果无法避免与中度CYP3A抑制剂并用,减低TAZVERIK的剂量。
2.强和中度CYP3A诱导剂:避免与TAZVERIK共同给药。
【Tazverik在特定人群中的使用】
哺乳期:建议不要母乳喂养。
【Tazverik包装供应/存储和处理方式】
TAZVERIK 200mg薄膜衣片为红色,圆形,双凸形,一侧凹陷有“ EZM 200”,另一侧凹陷了。 TAZVERIK可用于:
装有干燥剂的240片瓶; NDC 72607-100-00
请勿在30°C(86°F)以上的温度下存放。
完整说明资料附件:
https://www.tazverik.com/Content/pdf/prescribing-information.pdf
【包装规格】:200毫克/片 240片/瓶
【计价单位】:瓶
【生产厂家】:Epizyme, Inc
【商品名】:Tazverik
【药品名】:tazemetostat
【Tazverik作用机理】
1.Tazemetostat是甲基转移酶EZH2和一些EZH2功能获得性突变的抑制剂,包括Y646X,A682G和A692V。Tazemetostat还以392 nM的一半最大抑制浓度(IC50)抑制EZH1,约为抑制EZH2的IC50的36倍。
2.EZH2最有特色的功能是作为多梳抑制复合物2(PRC2)的催化亚基,催化组蛋白H3的赖氨酸27的单,二和三甲基化。组蛋白H3的三甲基化导致转录抑制。
3.SWItch/蔗糖不可发酵(SWI/SNF)复合物可拮抗PRC2在上皮样肉瘤患者某些基因表达的调节中的功能。某些SWI/SNF复杂成员(例如整合酶相互作用子1[INI1/SNF5/SMARCB1/BAF47],SMARCA4和SMARCA2)丧失或功能异常的临床前体外和体内模型可导致异常的EZH2活性或表达并导致致癌对EZH2的依赖。
4.Tazemetostat在体外抑制B细胞淋巴瘤细胞系的增殖,并在具有或不具有EZH2功能获得性突变的B细胞淋巴瘤的小鼠异种移植模型中显示出抗肿瘤活性。
5.Tazemetostat证明对具有突变EZH2的淋巴瘤细胞系增殖的抑制作用更大。
【Tazverik适应症和用途】
TAZVERIK是一种甲基转移酶抑制剂,可用于治疗:
1.16岁及以上患有转移性或局部晚期上皮样肉瘤的成人和儿科患者不符合完全切除的条件
2.成人复发或难治性滤泡性淋巴瘤患者,其肿瘤经美国食品药品管理局(FDA)批准的检测为EZH2突变阳性,并且至少接受过2种先前的全身疗法。
3.成人复发或难治性滤泡性淋巴瘤患者,没有令人满意的替代治疗选择。
这些指示根据总体响应率和响应时间在加速批准下获得批准。这些适应症的持续批准可能取决于验证试验中对临床益处的验证和描述。
【Tazverik剂量和给药】
建议的剂量为800毫克,每天口服两次,带或不带食物。
剂量形式和强度
片:200毫克
【Tazverik警告和注意事项】
1.继发性恶性肿瘤:TAZVERIK增加了发生继发性恶性肿瘤的风险,包括T细胞淋巴母细胞淋巴瘤,骨髓增生异常综合症和急性髓细胞性白血病。长期监测患者的继发性恶性肿瘤的发展。
2.胚胎-胎儿毒性:可引起胎儿伤害。建议患者有胎儿潜在危险,并使用有效的非激素避孕方法。
【Tazverik不良反应】
1.上皮样肉瘤患者最常见的不良反应(≥20%)为疼痛,疲劳,恶心,食欲下降,呕吐和便秘。
2.滤泡性淋巴瘤患者最常见的不良反应(≥20%)是疲劳,上呼吸道感染,肌肉骨骼痛,恶心和腹痛。
【Tazverik药物相互作用】
1.强和中度细胞色素P450(CYP)3A抑制剂:避免将强和中度CYP3A抑制剂与TAZVERIK并用。
如果无法避免与中度CYP3A抑制剂并用,减低TAZVERIK的剂量。
2.强和中度CYP3A诱导剂:避免与TAZVERIK共同给药。
【Tazverik在特定人群中的使用】
哺乳期:建议不要母乳喂养。
【Tazverik包装供应/存储和处理方式】
TAZVERIK 200mg薄膜衣片为红色,圆形,双凸形,一侧凹陷有“ EZM 200”,另一侧凹陷了。 TAZVERIK可用于:
装有干燥剂的240片瓶; NDC 72607-100-00
请勿在30°C(86°F)以上的温度下存放。
完整说明资料附件:
https://www.tazverik.com/Content/pdf/prescribing-information.pdf