艾日布林/艾立布林/艾瑞布林详细说明书
【药品名称】
通用名称:甲磺酸艾立布林注射液
英文名称:Eribulin Mesilate Injection
商品名称:海乐卫
【成份】
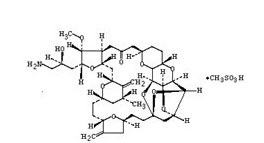
本品主要成份为甲磺酸艾立布林 化学式:(12E)-3,7:6,10-二脱水-2,4,5,12,13-五脱氧-8,9,11-三-O-[(1,1-二甲基乙基)二甲基硅烷基]-13-碘-L-阿拉伯-D-阿洛...
【适应症】
①转移性乳腺癌(先前接受过至少两种化学疗法治疗转移性疾病的患者);既往接受过至少两种化疗方案的局部晚期或转移性乳腺癌患者。
②无法切除或转移的脂肪肉瘤(先前接受过蒽环类药物治疗的患者),既往的化疗方案应包含一种蒽环类和一种紫杉烷类药物。
【剂型】
静脉注射液 1mg / 2mL(0.5mg / mL)
【用法用量】
乳腺癌(转移性)
表示先前已接受至少2种化疗方案治疗转移性疾病的患者的转移性乳腺癌; 既往治疗应包括蒽环类和紫杉烷,无论是辅助治疗还是转移性治疗
在21天周期的第1天和第8天,在2-5分钟内输注1.4毫克/平方米的静脉注射
脂肪肉瘤
适用于接受过含蒽环类药物治疗方案的患者中无法切除或转移性脂肪肉瘤的指征
在21天周期的第1天和第8天,在2-5分钟内输注1.4毫克/平方米的静脉注射
剂量调整
评估周围神经病变并在每次剂量之前获得CBC计数
推荐剂量延迟
对于以下任何一种情况,请勿在第1天或第8天进行管理
ANC <1,000 /mm³
血小板<75,000 /mm³
3级或4级非血液学毒性
第8天的剂量可能会延迟最多1周:
如果在第15天毒性无法消除或改善≤Grade2严重程度,则省略剂量
如果毒性在第15天消退或改善至≤Grade2严重程度,则以较低剂量给药并在2周后开始下一个周期
建议减少剂量
如果剂量因毒性而延迟,然后恢复至≤Grade2严重程度,则以减少的剂量恢复(见下文)
一旦剂量减少,不要再升级
对于以下任何一种情况,永久性地将1.4 mg /m²剂量降至1.1 mg /m²:
ANC <500 /mm³> 7天
ANC <1,000 /mm³伴有发烧或感染
血小板<25,000 /mm³
血小板<50,000 /mm³需要输血
非血液学3级或4级毒性
在前一周期中排除或延迟第8天的毒性剂量
对于以下任何一种情况,永久性地将剂量减少至0.7 mg /m²:
在接受1.1 mg /m²时需要永久减少剂量的任何事件的发生
中断
在接受0.7 mg /m²时需要永久剂量减少的任何事件的发生
肾功能不全
中度至重度(CrCl 15-49 mL / min):1.1 mg /m²IV
肝功能损害
轻度(Child-Pugh A):1.1 mg /m²IV
中等(Child-Pugh B):0.7 mg /m²IV
用药管理
静脉注射(IV)不相容
添加剂:葡萄糖
Y-site:葡萄糖
静脉注射(IV)兼容性
溶液:0.9%NaCl
静脉注射(IV)准备
用于IV给药的透明,无色,无菌溶液
每瓶含有1毫克艾立布林甲磺酸盐,为0.5毫克/毫升乙醇:水溶液(5:95)
静脉输液:无菌戒断剂量; 可以不经稀释或稀释(在0.9%NaCl 100 mL中)给药
丢弃未使用的小瓶部分
静脉注射(IV)管理
可以不经稀释或稀释(在0.9%NaCl 100 mL中)给药
管理超过2-5分钟
不要在含有右旋糖的IV系列溶液中稀释或给药
不要与其他医疗产品同时使用相同的IV系列
【存储】
将未稀释的艾立布林在室温下储存在注射器中4小时或在冷藏(40°F或/ 4°C)下储存24小时
在室温下储存稀释的艾立布林溶液最多4小时或在冷藏(40°F或/ 4°C)下储存最多24小时
【副作用及不良反应】
> 10%
中性粒细胞减少症(82%)
贫血(58%)
虚弱/疲劳(54%)
脱发(45%)
周围神经病变(35%)
恶心(35%)
便秘(25%)
关节痛/肌痛(22%)
发火(21%)
减肥(21%)
厌食症(20%)
头痛(19%)
呕吐(18%)
腹泻(18%)
背痛(16%)
呼吸困难(16%)
咳嗽(14%)
骨痛(12%)
肢体疼痛(11%)
尿路感染(10%)
1-10%
流泪增加
消化不良
腹痛
口腔炎
口腔干燥症
URI
低钾血症
肌肉痉挛/虚弱
味觉障碍
头晕
失眠
萧条
皮疹
上市后报告
胃肠道疾病:胰腺炎
血液和淋巴系统疾病:淋巴细胞减少症
肝胆疾病:肝毒性
免疫系统疾病:药物过敏
感染和感染:肺炎,败血症/中性粒细胞减少性败血症
代谢和营养障碍:低镁血症,脱水
呼吸道,胸腔和纵隔疾病:间质性肺病
皮肤和皮下组织疾病:瘙痒症,史蒂文斯 – 约翰逊综合征,中毒性表皮坏死松解症
【警告】
禁忌 不清楚
【注意事项】
每次剂量前监测周围神经病变(见剂量修改)
报告了严重的中性粒细胞减少症; 监测每次剂量前的全血细胞计数(见剂量修改); 增加3级或4级血细胞减少患者的监测频率; 延迟治疗并减少患有发热性中性粒细胞减少症或持续超过7天的4级中性粒细胞减少症患者的后续剂量
如果ANC <1,000 /m³,血小板<75,000 /m³,或3-4级非血液学毒性,则延迟给药和/或减少剂量(见剂量修改)
注意CHF,缓慢性心律失常和先天性长QT综合征(监测QT间期延长); 在给药前纠正低钾血症或低镁血症
当与其他延长QT间期的药物共同给药时可能会引起累加效应(例如,Ia或III类抗心律失常药,thioridazine,红霉素)
基于动物研究及其作用机制,当给予孕妇或具有生殖潜力的女性伴侣的男性时,可能导致胎儿伤害
【贮藏】
在室温下未稀释的eribulin可储存在注射器中长达4小时,或冷藏在(40°F或/4°C)下可储存长达24小时
在室温下将稀释的eribulin溶液最多保存4小时,或者在冷藏(40°F或/4°C)下最多保存24小时
【作用机制】
Halaven(甲磺酸艾立布林)是一种非紫杉烷微管动力学抑制剂。它是从海洋海绵鼠笼中分离出的产品芦丁素B的合成类似物。依立布林抑制微管的生长期而不影响其缩短期,并将微管蛋白螯合为非生产性聚集体。Eribulin通过基于微管蛋白的抗有丝分裂机制发挥作用,导致G2 / M细胞周期阻滞,有丝分裂纺锤体破裂,并最终导致有丝分裂长期受阻后凋亡细胞死亡。
【疗效和安全】
FDA对Halaven的批准是基于一项针对762名转移性乳腺癌患者的开放标签,随机,多中心试验,这些患者接受了至少两种化疗方案,并且在其最后一次化疗方案后六个月内经历了疾病进展。将受试者随机分组接受Halaven(n=508)或在随机分组之前选择的单药治疗(n=254)。根据地理区域,HER2/neu状态和以前的卡培他滨暴露情况对随机分组进行分层。在21天周期的第1天和第8天,以1.4mg/m2的剂量施用Halaven。接受Halaven治疗的患者接受了5个疗程的中位数治疗。对照组的治疗包括97%的化疗和3%的激素治疗。主要疗效结果是总体生存率。在Halaven组与安慰剂组之间,观察到总体存活率有统计学上的显着改善:在Halaven组中508名受试者死亡274例死亡,而在对照组中254名受试者中148例死亡(p=0.041)。当观察到77%的事件且与主要分析一致(分别为386例与203例死亡)时,进行了更新的,计划外的生存分析。根据RECIST标准,Halaven组的客观缓解率为11%,中位缓解持续时间为4.2个月。分别有203人死亡)。根据RECIST标准,Halaven组的客观缓解率为11%,中位缓解持续时间为4.2个月。分别有203人死亡)。根据RECIST标准,Halaven组的客观缓解率为11%,中位缓解持续时间为4.2个月。
【批准文号】
进口药品注册证号H20190042
【生产企业】
NerPharMa S.r.l.