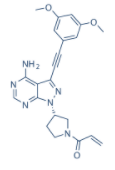
药品概述
2022年3月30日,Taiho Oncology发布的公告中称,FDA已经授予其研发的FGFR抑制剂Futibatinib(TAS-120)优先审查资格,用于治疗FGFR2基因重排(包括融合)的经治的局部晚期或转移性胆管癌患者。
该申请基于Ⅱb期FOENIX-CCA2试验(NCT02052778)的结构。与2020年ESMO大会上公布的阶段性研究成果相比,TAS-120的缓解率以及缓解持续时间数据有了进一步的提升,潜力更明显地展现了出来。
根据目前已经公开的数据,在103例局部晚期或转移性的不可切除的FGFR2重排肝内胆管癌患者中,TAS-120治疗的整体缓解率为41.7%,缓解持续时间为9.7个月,其中72%的患者缓解持续时间在6个月以上。
2022年9月30日,日本大鹏药品(Taiho Pharmaceutical)和子公司Taiho Oncology宣布,美国FDA已加速批准Lytgobi(futibatinib)片剂上市,用于治疗携带FGFR2基因融合或其它重排的不可切除、局部晚期或转移性肝内胆管癌经治成人患者。
简要说明书
| Futibatinib 福巴替尼(Lytgobi)说明书 | |
| 药物: | Futibatinib 福巴替尼(Lytgobi) |
| 中国上市情况: | 未上市 |
| 治疗: |
适用于患有先前治疗过的、不可切除的、局部晚期或转移性肝内胆管癌的成人患者的治疗,所述肝内胆管癌包含成纤维细胞生长因子受体2 (FGFR2)基因融合或其他重排。 |
| 参考用法用量: |
|
| 不良反应: | 最常见的不良反应(≥20%)为指甲毒性、肌肉骨骼疼痛、便秘、腹泻、疲劳、口干、脱发、口腔炎、腹痛、皮肤干燥、关节痛、味觉障碍、干眼、恶心、食欲下降、尿路感染、掌-跖红感觉异常综合征和呕吐。 |