药品概述
2020年12月25日,诺诚健华公司研发的BTK抑制剂奥布替尼(orelabrutinib)正式获得中国国家药监局(NMPA)批准上市,用于(1)既往至少接受过一种治疗的成人套细胞淋巴瘤(MCL)患者;(2)既往至少接受过一种治疗的成人慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)患者。对于诺诚健华而言,奥布替尼的获批意义重大,这是该公司首款获批上市的创新药,标志着公司从临床开发全面进入商业化阶段。
这是NMPA批准的第10个原创国产小分子激酶抑制剂,国内公司研发的第2个BTK抑制剂,也是全球上市的第5个BTK抑制剂。NMPA此前批准的激酶抑制剂分别为:1)埃克替尼(EGFR,2011);2)阿帕替尼(VEGFR,2014);3)安罗替尼(VEGFR/PDGFR/KIT,2018);4)吡咯替尼(HER2,2018);5)呋喹替尼(VEGFR,2018);6)泽布替尼(BTK,2019);7)甲磺酸氟马替尼(ABL,2019);8)甲磺酸阿美替尼(EGFR-T790M,2020);9)恩莎替尼(ALK,2020)。而FDA目前共计批准了62个小分子激酶抑制剂。
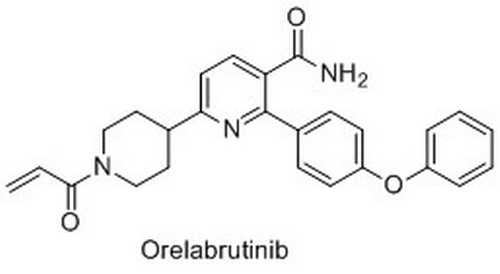
奥布替尼是一种口服BTK抑制剂,与BTK不可逆结合,诱导下游激酶失活和细胞死亡。据诺诚健华官网显示,奥布替尼的骨架中心为一单环,而非稠环,这一独特的结构导致奥布替尼具有高选择性、低非靶向副作用。
2021年12月3日,中国国家医保局发布了2021年《国家基本医疗保险、工伤保险和生育保险药品目录(2021年)》(以下简称“国家医保目录“)。奥布替尼进入新版医保目录。
医保内适应症范围
1.既往至少接受过一种治疗的成人套细胞淋巴瘤患者。
2.既往至少接受过一种治疗的成人慢性淋巴细胞白血病/小淋巴细胞淋巴瘤患者。
2023年4月20日,中国国家药品监督管理局正式批准奥布替尼用于既往至少接受过一种治疗的成人边缘区淋巴瘤(MZL)患者的新适应症上市许可申请,使其成为中国首个且目前唯一针对MZL的BTK抑制剂,给中国MZL患者带来了新的治疗选择。此外,奥布替尼还在中国开展治疗多种B细胞淋巴瘤亚型的临床试验,未来有望造福更多中国淋巴瘤患者。
简要说明书
| Orelabrutinib奥布替尼(宜诺凯)说明书 | |
| 药物: | 奥布替尼片 |
| 中国上市: | 已上市 |
| 治疗: |
一、既往至少接受过一种治疗的成人套细胞淋巴瘤(MCL) 患者。 |
| 参考用法用量: | 推荐剂量为每次150mg(3片50mg的片剂),口服,每日一次,直至疾病进展或出现不可耐受的毒性。 |
| 不良反应: |
出血、感染、血小板减少症、乙型肝炎再激活、第二原发恶性肿瘤、高血压、心律失常 |