药品概述
2021年8月18日,FDA加速批准葛兰素史克(GSK)PD-1抑制剂dostarlimab-gxly治疗携带错配修复缺陷(dMMR)的晚期实体瘤患者,这些患者在接受既往含铂治疗方案后发生进展或无任何合适治疗方案。
此次批准基于GARNET试验 (NCT02715284),这是一项正在进行的Ⅰ期多中心、非随机、多平行队列、开放标签试验,主要研究dostarlimab-gxly单药在晚期实体肿瘤患者中的疗效。该研究的2B部分包括5个扩展癌种分别是dMMR/MSI-H子宫内膜癌(A1组),pMMR(MMR功能完整)/微卫星稳定子宫内膜癌(A2组),非小细胞肺癌(NSCLC)(E组), dMMR/MSI-H非子宫内膜或POLE突变的实体肿瘤(F组)以及无BRCA突变的铂耐药卵巢癌(G组)。
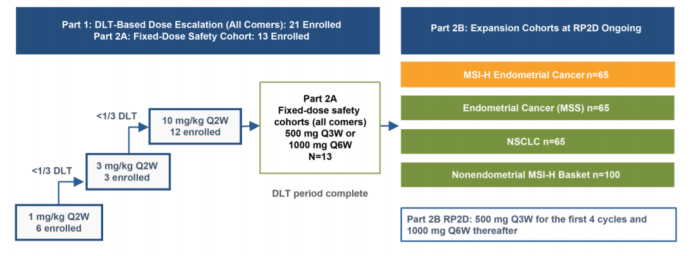
入组患者接受每3周一次剂量为500mg的dostarlimab-gxly的静脉注射,共4次; 随后每6周给药1000mg,治疗一直持续到疾病进展或出现患者无法忍受的毒性。
结果显示,在所有dMMR实体瘤患者中(n = 209),该药物的客观缓解率(ORR)为41.6% (95% CI, 34.9-48.6);其中部分应答(PR)率为32.5%。此外,中位缓解持续时间(DOR)为34.7个月(范围2.6-35.8+),95.4%的患者持续缓解≥6个月。另外,在dMMR非子宫内膜癌组中(n = 106),ORR为38.7% (95% CI, 29.4-48.6)。
这是dostarlimab今年获批的第二个适应症,早在 2021 年 4 月,FDA 已加速批准 dostarlimab 用于治疗 dMMR 复发或晚期子宫内膜癌的成年患者。
简要说明书
|
多塔利单抗 Dostarlimab-gxly(Jemperli)说明书 |
|
| 药物: |
Dostarlimab-gxly(Jemperli)注射液 |
| 中国上市: | 未上市 |
| 治疗: |
治疗接受含铂化疗期间或之后疾病进展,且携带错配修复缺陷(dMMR)DNA修复异常的复发或晚期子宫内膜癌患者。 |
| 参考用法用量: |
第1-4剂用药为500mg、每3周一次。从第4剂后3周开始的后续给药(从第5剂开始):1000mg、每6周一次。Jemperli通过静脉输液给药,输注时间大于30分钟。 |
| 不良反应: |
常见的副作用包括输液相关反应:疲劳、恶心、腹泻、贫血和便秘。 |
