NK细胞、T细胞、B细胞等都属于免疫系统的成员。本文为大家讲解NK细胞的发育过程、受体特性、解决方案、功能及实际应用。
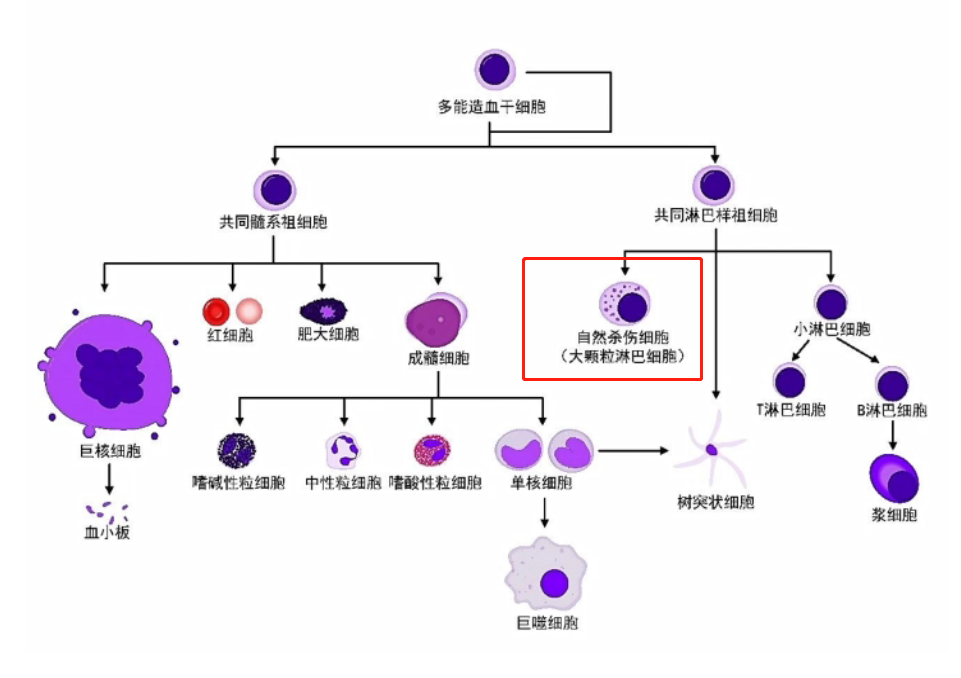
自然杀伤细胞(Natural killer cell,NK细胞 ),是除T细胞、B细胞之外的第三大类淋巴细胞。
NK细胞是体内负责杀伤老化、受病毒感染、肿瘤等异常细胞的最主要“战士”。
NK细胞不表达T细胞和B细胞所特有的膜表面分子,无需抗原的预先刺激与活化即可直接杀伤被病毒感染的自身细胞或肿瘤细胞,与抗肿瘤、抗感染和免疫调节有关,是固有免疫最重要的组成成分之一。因此也被称为人体抗癌第一道防线。
目前主流的NK细胞发育模型认为,NK细胞来源于骨髓中的CD34+CD45RA+造血祖细胞(HPCs)。
在骨髓中,NK细胞由HPCs通过常见的淋巴样祖细胞(CLPs)和NK细胞前体(NKPs)发展而来,然后迁移到外周血(Conventional NK cells,cNK细胞)或组织(tissue-resident NK cells,trNK细胞)。
NK细胞的发育主要包括4个分化过程:
在与特定配体结合后,NK 细胞通过几种胚系编码的受体(Ig样家族I型蛋白或 C型凝集素样受体(CTLR)家族的II型蛋白)持续检查邻近细胞的健康状况。这些受体传递的活化和抑制信号之间的平衡精细地调节了 NK 细胞功能。
传递活化信号的关键是 ITAM 的磷酸化,更多地包含在其相关的适配蛋白中。受体跨膜结构域中带正电荷氨基酸的存在允许这种结合。相反,表现出抑制能力的受体显示出包含 ITIM 的长细胞质尾部,其酪氨酸磷酸化允许募集酪氨酸磷酸酶和转导抑制信号。一般而言,抑制性受体本身不发挥作用,而是调节活化受体传递的信号强度。
NK细胞的受体分类可以参见下方两个表:
NK细胞通过平衡信号对病毒感染和转化细胞产生应答。
NK细胞通过激活型受体(如,NKG2D)和自然细胞毒性受体(NCR,如NKp30、NKp44、NKp46)识别missing self的靶细胞(如感染病毒、肿瘤细胞或处于衰老状态的细胞)。
NK细胞通过激活受体激活信号通路(如ITAM或YINM),释放perforin和granzyme等物质诱导靶细胞凋亡。此外,外周血中的CD56dim NK细胞可通过CD16介导的ADCC效应杀伤靶细胞。
抑制性受体(如KIR家族和CD94/NKG2A异二聚体)识别MHC-I分子,调节NK细胞活性。
NK细胞表达趋化因子和各种不同的受体,如,CD56bright NK细胞表达与骨髓或淋巴结定居相关的趋化受体,而CD56dim NK细胞表达CX3CR1、ChemR23或CXCR1。NK细胞通过受体和趋化因子的多样性调控其识别和攻击靶细胞的能力。
在识别配体后,NK细胞表面的激活受体通过适配蛋白DAP10和DAP12启动细胞内信号传导。这些信号通路刺激与细胞因子和细胞毒性相关的基因转录,发挥NK细胞监视的关键功能。
NK细胞激活的信号传导路径包括多个重要的通路。激活NK细胞受体后,适配蛋白DAP10和DAP12的磷酸化启动下游信号传导。磷脂酰肌醇3-激酶(PI3K)的激活通过招募AKT蛋白,促进细胞存活和代谢。MAPK通路也被激活,引发一系列磷酸化事件,最终导致基因转录和细胞因子分泌。
PLCγ2引发内质网中钙离子的释放并激活PKC,造成NFAT去磷酸化。去磷酸化的NFAT迁移到细胞核,促进与NK细胞细胞毒性和细胞因子产生相关的基因转录。
在免疫抑制性的肿瘤微环境中,TGF-β1通过mTOR通路抑制IL-15促进的NK细胞活化。
NK细胞最早发现于上世纪七十年代,至今人们对其生理学机制及应用仍在不断探索。近年来肿瘤免疫疗法、细胞疗法、基因编辑等新技术不断获得突破,其中基于NK细胞的创新疗法也显现巨大的临床转化潜力。
根据设计思路的不同,基于NK细胞的创新疗法分为激活杀伤活化受体和阻断杀伤抑制受体两条路径,细分为5种策略。
作为抗癌的第一道防线,NK细胞已经成为免疫治疗临床试验中重要的一环。早在公元2000年,研究就已经证实小鼠癌症的发生和NK细胞自身的缺陷有关。随着NK细胞在抗肿瘤方面的探索愈发深入,越来越多的临床研究者希望了解NK细胞是如何对抗肿瘤的。
1)内在杀伤能力
NK细胞是高度特化的细胞毒性细胞,依靠来自激活受体、抑制受体、细胞因子受体和趋化因子受体的多种信号的整合来识别和消除其靶标。一旦进入细胞毒性状态,NK细胞(与T细胞不同)在攻击靶标之前不需要任何的抗原启动,因此可以通过多种机制快速有效地杀死靶细胞。
2)特异性杀伤能力
通过基因编辑免疫细胞表达CAR会定向其特异性靶标,并将其杀伤能力集中在特定抗原上。CAR分子的基本结构包括由单链可变片段(scFv)组成的抗原识别结构域、细胞外铰链结构域、跨膜结构域和细胞内信号转导结构域。 其中scFv赋予了CAR特异性识别并结合靶抗原的能力,当CAR结构识别靶细胞后形成类似的免疫突触并启动免疫反应,促使免疫细胞杀死靶细胞。
3)安全性特征
在安全性能上,除了CAR-NK疗法能够在一定程度上避免巨大CRS和ICANS外,CAR-NK细胞的寿命比较短,这意味着CAR-NK在血液循环中停留的时间相对较短,不用顾虑CAR结构对机体的长期安全性问题。有人认为这一特性或许会导致CAR-NK细胞疗效不如CAR-T,但是从安全性的角度来说,这种特性反而避免了经过基因修饰的免疫细胞长期存在于人体可能导致的一系列未知的风险等。目前CAR-NK细胞已成为比较热门的研究方向,当然基于CAR疗法的研究其他细胞群也具有特定的优势。现阶段也有许多正在进行的早期临床试验来研究这些新的免疫细胞。
总的来说,CAR-NK是一种极具潜力的细胞疗法,相对比CAR-T来说安全性更好,且有望通过各种技术手段大规模生产即用或现货型产品,大大的降低了成本。当然CAR-NK作为一种新兴的细胞疗法同时面临着巨大的挑战,相信在不久的将来,随着技术的发展困难会迎刃而解。
NK细胞可以减轻或增强人类多种疾病的严重程度,根据不同的作用机制,科研人员正在开发针对不同疾病的基于NK细胞的治疗方案。
1)NK细胞与癌症
哈佛医学院皮肤科和癌症研究中心发表在《免疫学》杂志的一项研究成果NK细胞可以控制肿瘤的转移和生长,还可以降低癌症患者复发的风险。科学家发现,如果成年人的NK细胞活性较低,患癌症的风险就会增加。
2)NK细胞与病毒感染
在Science Translational Medicine杂志上发表的一项题为“Natural Killer cells for antiviral therapy”的文章中,证实了NK细胞可防御多种不同的病毒,如登革热病毒、呼吸道合胞病毒、西尼罗河病毒、流感病毒和日本脑炎病毒。
NK细胞可以抑制HIV的复制并破坏感染该病毒的细胞。NK细胞还可以通过产生IFN-γ等细胞因子来减少病毒在体内的传播。然而,在HIV-1感染过程中,会产生一种名为 Nef(负调节因子)的蛋白质,它可以帮助病毒感染的细胞逃避NK细胞的检测。在这种感染过程中,NK细胞上的激活受体减少,而抑制性受体显着增加。此外,NK细胞疗法可用于对标准治疗无反应的HIV患者。
3)NK细胞与糖尿病
在一篇题为“Targeting natural killer cell reactivity by employing antibody to NKp46: implications for type 1 diabetes”研究中,科学家发现NK细胞激活受体NKp46在1型糖尿病的发展中发挥着重要作用。NKp46与胰岛素分泌β细胞表面表达的配体结合,导致这些细胞遭到破坏。
NK细胞和其他免疫细胞会引起称为胰岛的胰腺区域的炎症。研究发现,长期患有糖尿病的患者,NK细胞激活受体的表达和NK细胞的活性降低。科学家还发现,施用阻断NKp46的抗体可以减轻NK细胞在糖尿病发生过程中的作用。
4)NK细胞与类风湿关节炎
NK细胞和其他免疫细胞可导致类风湿关节炎的关节破坏。这些细胞还可以通过产生IFN-γ来控制这种疾病的严重程度。
NK细胞在类风湿性关节炎患者的滑液中积聚,导致关节炎症。滑膜中的NK细胞产生信号分子,例如巨噬细胞集落刺激因子 (M-CSF) 和核因子κB受体活化因子配体(RANKL),可增加骨吸收。类风湿性关节炎患者外周血中NK细胞的细胞毒功能受损。
5)NK细胞与阿尔兹海默症
23年10月,阿尔茨海默病临床试验(CTAD)年会公布了研究性NK细胞疗法SNK01治疗阿尔茨海默病(AD)患者的I期试验数据。 
▲I期临床实验研究的最终数据证明SNK01耐受性良好,似乎可以降低试验患者的阿尔茨海默病血液标志物:Aβ42/40淀粉样蛋白,并减轻神经炎症。并且90%的患者在11周后表现出改善或保持稳定的认知功能,这表明SNK01可能不仅仅缓解更能有效治疗阿尔茨海默症。
6)NK细胞与多发性硬化症
多发性硬化症患者的NK细胞数量较低。在这种疾病中,激活的T细胞会破坏神经纤维周围称为髓磷脂的绝缘层。NK细胞可以通过消除T细胞来控制这种疾病的严重程度。
7)NK细胞与系统性红斑狼疮
国际医学期刊《immunity》上的一篇文章介绍了一种来源于NK细胞的先天淋巴细胞种群——NKRM细胞,即组织驻留记忆自然杀伤细胞。这一细胞能够阻止自身过度免疫。
在小鼠实验中,研究人员初步证明了NKRM细胞可以通过TRAIL介导的方式消除CD4+T细胞,从而减少T细胞介导的自身免疫。这也意味着这一细胞疗法在治疗Sjogren综合征、系统性红斑狼疮等自身免疫疾病上具有潜力。
同时,NK细胞疗法不仅在血液肿瘤,还是转移性实体肿瘤,在正在进行的多项I/II期试验显示了可行性和潜在的疗效。NK细胞疗法的独特优势使它成为对抗肿瘤的多功能工具。在这个不断发展的环境中,NK细胞药物是有前途的药物,引导我们走向未来,癌症治疗不仅仅是一场战斗,而是一种个性化的、有针对性的、有效的治疗策略。
Part.1 NK细胞简介
自然杀伤细胞(Natural killer cell,NK细胞 ),是除T细胞、B细胞之外的第三大类淋巴细胞。
NK细胞是体内负责杀伤老化、受病毒感染、肿瘤等异常细胞的最主要“战士”。
NK细胞不表达T细胞和B细胞所特有的膜表面分子,无需抗原的预先刺激与活化即可直接杀伤被病毒感染的自身细胞或肿瘤细胞,与抗肿瘤、抗感染和免疫调节有关,是固有免疫最重要的组成成分之一。因此也被称为人体抗癌第一道防线。
Part.2 NK细胞发育
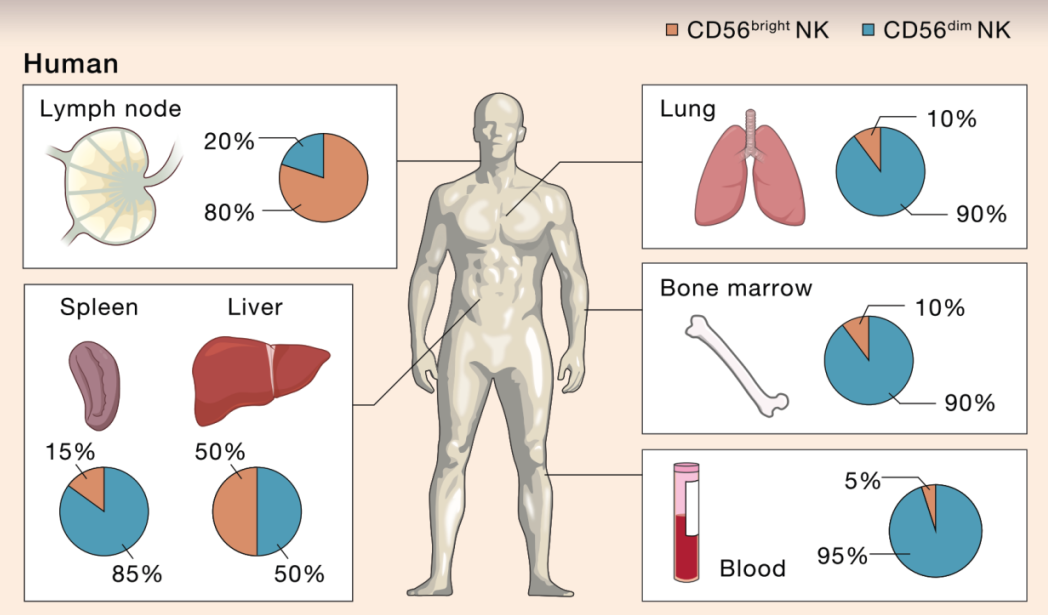
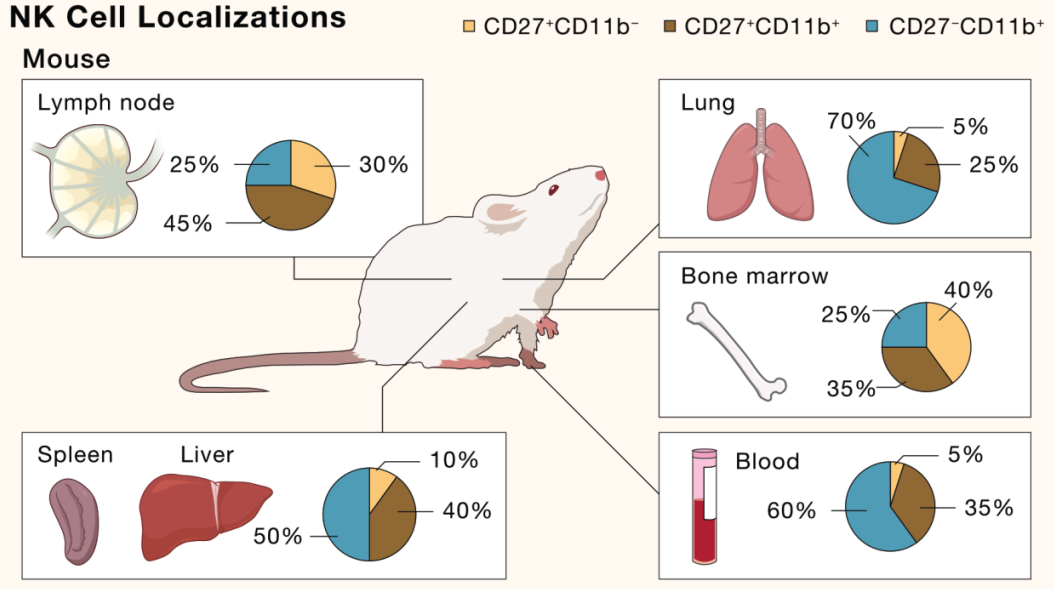
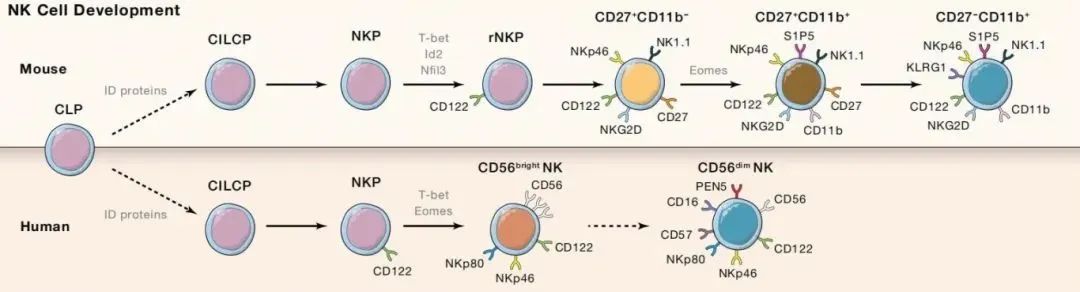
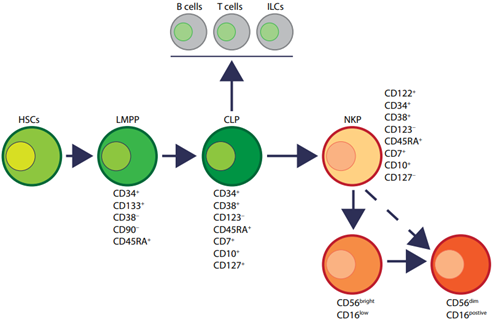
▲人类和小鼠中NK细胞发育,DOI: 10.1016/j.cell.2020.02.029
目前主流的NK细胞发育模型认为,NK细胞来源于骨髓中的CD34+CD45RA+造血祖细胞(HPCs)。
在骨髓中,NK细胞由HPCs通过常见的淋巴样祖细胞(CLPs)和NK细胞前体(NKPs)发展而来,然后迁移到外周血(Conventional NK cells,cNK细胞)或组织(tissue-resident NK cells,trNK细胞)。
NK细胞的发育主要包括4个分化过程:
- 1)Lin-CD34造血干细胞(Hematopoietic Stem Cells,HSCs)分化为CD45 RA淋巴引发的多能祖细胞(Lymphoid-primed Multipotent Progenitor,LMPP);
- 2)LMPP先表达CD38、CD7、CD10和CD127,之后逐渐转变为常见的淋巴祖细胞(Common Lymphoid Progenitors,CLP),进而分化为Pro-B、Pre-T、NK细胞祖细胞(NKPs)或其他先天性固有淋巴细胞等多种淋巴细胞;
- 3)CLP若表达CD122(IL-2Rβ)则标志着进入NK细胞谱系的分化路线,且不可逆转,之后逐渐发育为未成熟NK细胞(Immature NK cells,iNK);
- 4)NK细胞的发育情况与CD34、CD117、CD56和CD94的表达水平密切相关,CD56(神经细胞粘附分子)的出现标志着iNK细胞转变为成熟NK细胞。大多数iNK细胞先转变为CD56bright NK细胞,然后转变为CD56dimNK细胞,部分iNK细胞可以直接分化为CD56dim NK细胞。
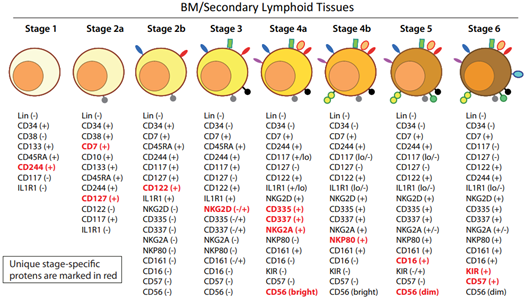
- NK细胞在从第1阶段(LMPP)开始的整个发育过程中均表达CD244(2B4)分子;
- 2a期和2b期(CLP)的特征分子分别为CD117和低水平的IL-1R1;
- IL-1R1的高表达是第3阶段(iNK细胞)的重要标志,NKG2D、CD335、CD337和CD161等分子的表达也是该阶段的显著特征;
- 4a和4b阶段是iNKs发育为成熟NK细胞的重要过程,NKG2D、CD335、CD337和CD161等多种分子的表达均在此时达到最高水平,NKp80的表达是4a向4b过渡的重要标志;
- CD56dim的表达减少以及CD16(Fc γ RIIIA)和杀伤性免疫球蛋白样受体(KIR)(CD158)的表达上升标志着NK细胞从4b进入第5阶段;
- 第6阶段则主要是“抗原”暴露后机体产生的“适应性”或“记忆样”NK细胞,高表达的NKG2C是该阶段的标志性分子。
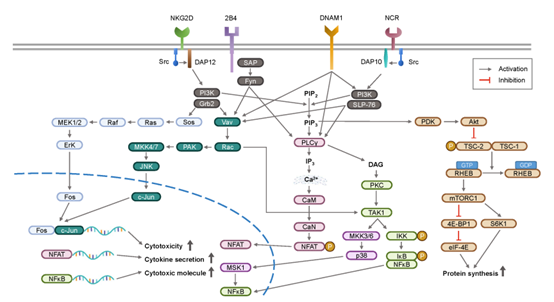
Part.3 NK细胞受体:激活和抑制
在与特定配体结合后,NK 细胞通过几种胚系编码的受体(Ig样家族I型蛋白或 C型凝集素样受体(CTLR)家族的II型蛋白)持续检查邻近细胞的健康状况。这些受体传递的活化和抑制信号之间的平衡精细地调节了 NK 细胞功能。
传递活化信号的关键是 ITAM 的磷酸化,更多地包含在其相关的适配蛋白中。受体跨膜结构域中带正电荷氨基酸的存在允许这种结合。相反,表现出抑制能力的受体显示出包含 ITIM 的长细胞质尾部,其酪氨酸磷酸化允许募集酪氨酸磷酸酶和转导抑制信号。一般而言,抑制性受体本身不发挥作用,而是调节活化受体传递的信号强度。
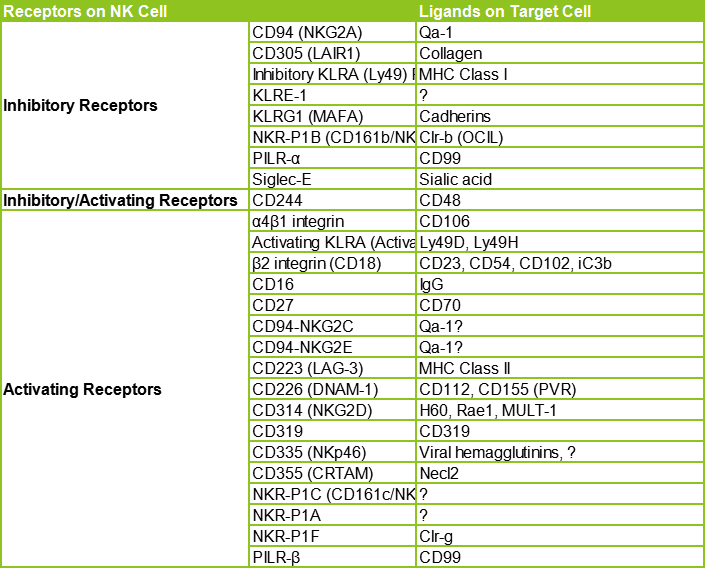
NK细胞的受体分类可以参见下方两个表:
NK细胞通过平衡信号对病毒感染和转化细胞产生应答。
NK细胞通过激活型受体(如,NKG2D)和自然细胞毒性受体(NCR,如NKp30、NKp44、NKp46)识别missing self的靶细胞(如感染病毒、肿瘤细胞或处于衰老状态的细胞)。
NK细胞通过激活受体激活信号通路(如ITAM或YINM),释放perforin和granzyme等物质诱导靶细胞凋亡。此外,外周血中的CD56dim NK细胞可通过CD16介导的ADCC效应杀伤靶细胞。
抑制性受体(如KIR家族和CD94/NKG2A异二聚体)识别MHC-I分子,调节NK细胞活性。
NK细胞表达趋化因子和各种不同的受体,如,CD56bright NK细胞表达与骨髓或淋巴结定居相关的趋化受体,而CD56dim NK细胞表达CX3CR1、ChemR23或CXCR1。NK细胞通过受体和趋化因子的多样性调控其识别和攻击靶细胞的能力。
在识别配体后,NK细胞表面的激活受体通过适配蛋白DAP10和DAP12启动细胞内信号传导。这些信号通路刺激与细胞因子和细胞毒性相关的基因转录,发挥NK细胞监视的关键功能。
NK细胞激活的信号传导路径包括多个重要的通路。激活NK细胞受体后,适配蛋白DAP10和DAP12的磷酸化启动下游信号传导。磷脂酰肌醇3-激酶(PI3K)的激活通过招募AKT蛋白,促进细胞存活和代谢。MAPK通路也被激活,引发一系列磷酸化事件,最终导致基因转录和细胞因子分泌。
PLCγ2引发内质网中钙离子的释放并激活PKC,造成NFAT去磷酸化。去磷酸化的NFAT迁移到细胞核,促进与NK细胞细胞毒性和细胞因子产生相关的基因转录。
在免疫抑制性的肿瘤微环境中,TGF-β1通过mTOR通路抑制IL-15促进的NK细胞活化。
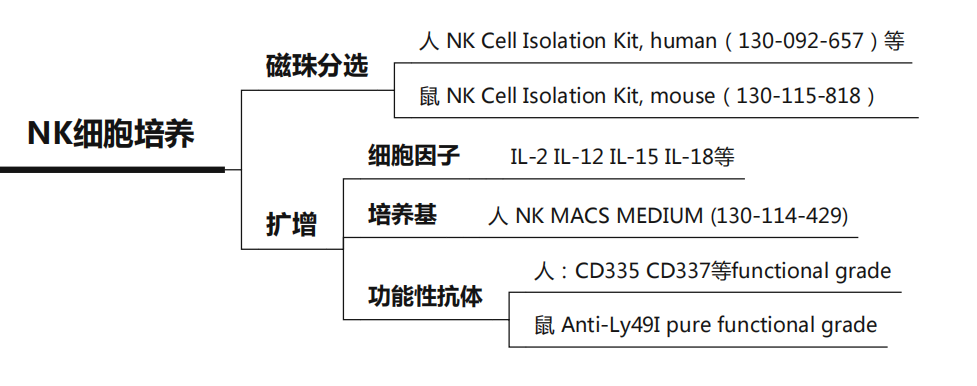
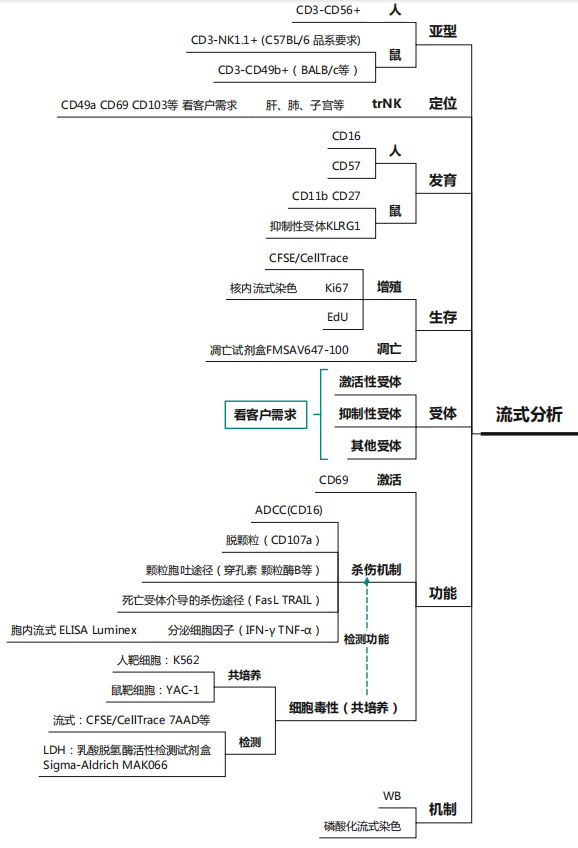
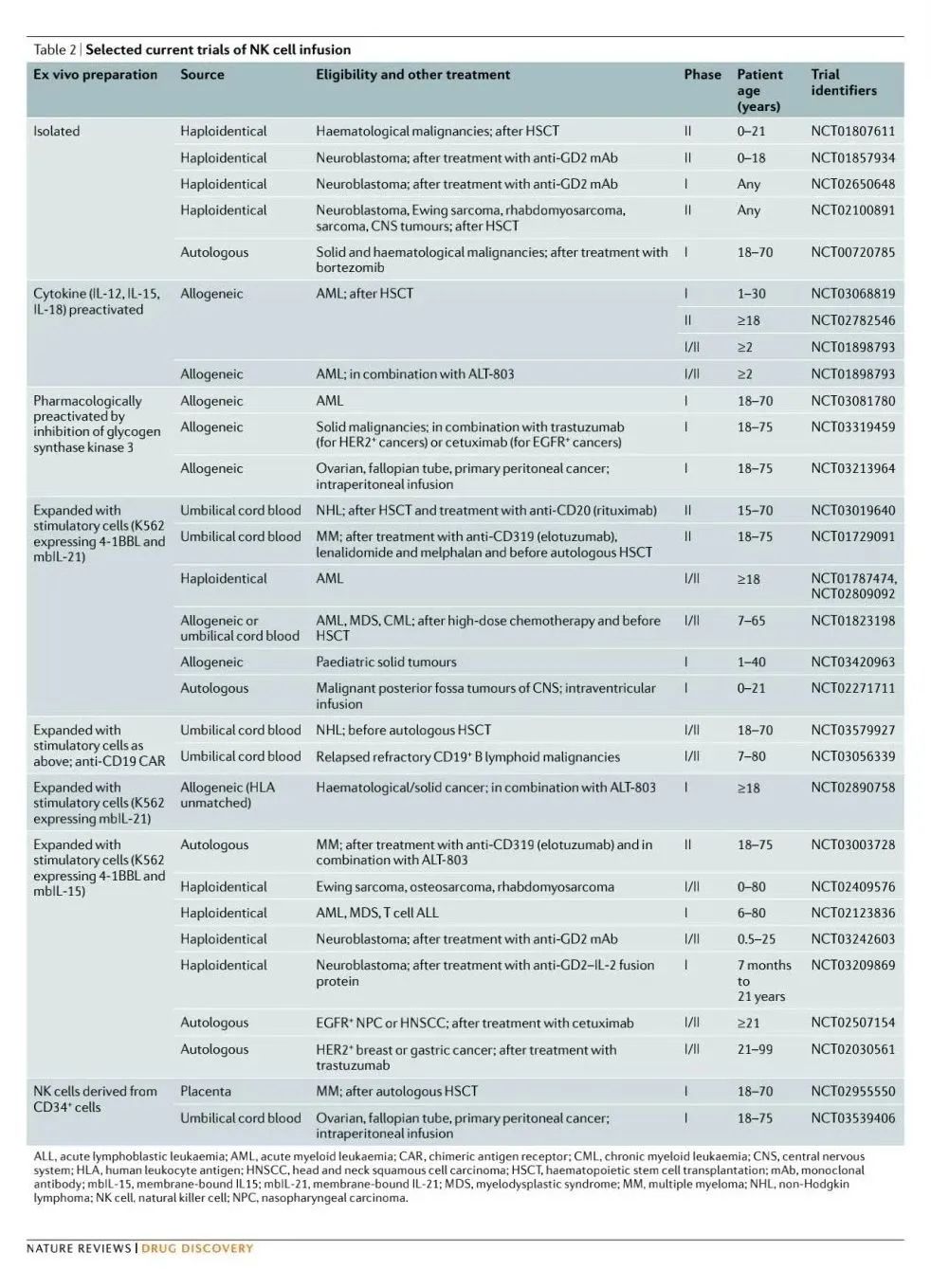
Part.4 NK细胞解决方案
Part.5 NK细胞功能&应用
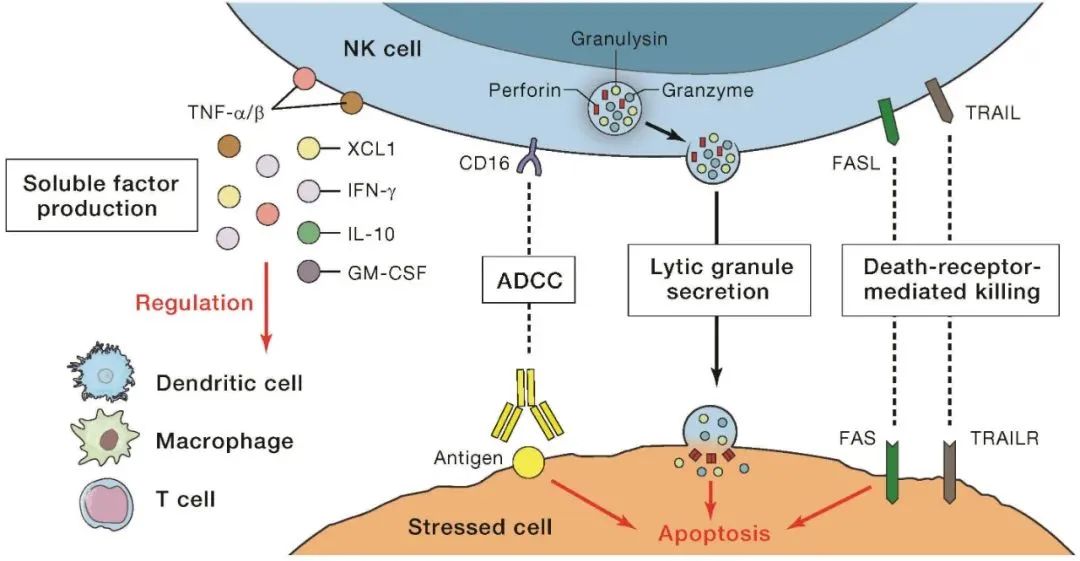
NK细胞的功能
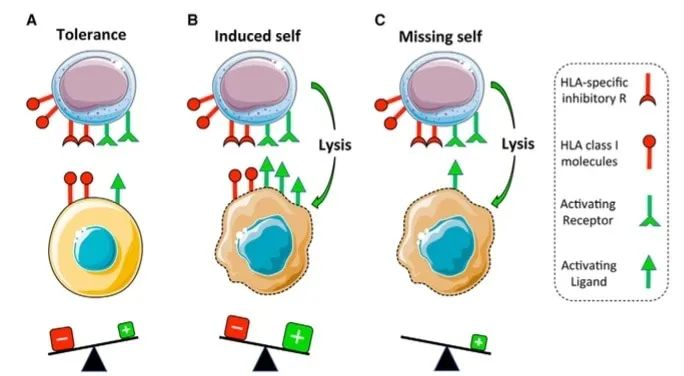
总的来说,NK细胞作为免疫系统中的重要组成部分,具有独特的识别和杀伤机制,对抗肿瘤、感染和其他疾病起着重要作用。- 识别机制:NK细胞通过表面上的受体来识别靶细胞。最为重要的是Killer Cell Immunoglobulin-like Receptors (KIRs)和NKG2D受体,它们可以识别肿瘤细胞表面的变异抗原或缺失的MHC-I分子,从而区分正常细胞和异常细胞。
- 杀伤机制:NK细胞可以通过多种方式杀伤靶细胞,包括释放穿孔蛋白质(如穿孔素)、诱导凋亡(通过释放细胞毒素如颗粒酶)和调动其他免疫细胞(如巨噬细胞)来清除靶细胞。
- 激活和抑制:NK细胞表面同时具有激活受体和抑制受体。抑制受体主要识别MHC-I分子,正常细胞表面MHC-I分子的存在可以抑制NK细胞的杀伤作用,而异常细胞通常缺失MHC-I,使得NK细胞得以发挥作用。
- 免疫调节:NK细胞与多种免疫细胞(如树突状细胞DCs、T细胞、巨噬细胞)相互作用,形成复杂的免疫网络。NK细胞可通过释放IFN-γ等因子激活DCs,增强其抗原呈递能力,从而促进T细胞的激活和分化。NK细胞还能通过细胞接触或分泌的细胞因子调节T细胞的极化(Th1/Th2平衡),以及影响巨噬细胞的活化状态和功能。
- 免疫监视:NK细胞参与机体的免疫监视,监测和清除早期肿瘤细胞,预防肿瘤的发生和发展。
- 免疫治疗:近年来,利用NK细胞进行免疫治疗的研究逐渐成为热点。采用NK细胞治疗、CAR-NK细胞治疗等方法,可以增强NK细胞的活性和数量,提高对肿瘤细胞的杀伤能力。
基于NK细胞的治疗策略
NK细胞最早发现于上世纪七十年代,至今人们对其生理学机制及应用仍在不断探索。近年来肿瘤免疫疗法、细胞疗法、基因编辑等新技术不断获得突破,其中基于NK细胞的创新疗法也显现巨大的临床转化潜力。
根据设计思路的不同,基于NK细胞的创新疗法分为激活杀伤活化受体和阻断杀伤抑制受体两条路径,细分为5种策略。
- 1)细胞因子疗法:IL-2和IL-15,可提高机体内NK细胞活性,但潜在的恶化免疫反应是一个安全问题。
- 2)NK细胞的过继性细胞疗法(Adoptive Cell Therapy, ACT):向患者输注健康的经活化的NK细胞,其中回输的NK细胞在体外经过IL-2、IL-15等细胞因子的活化处理。
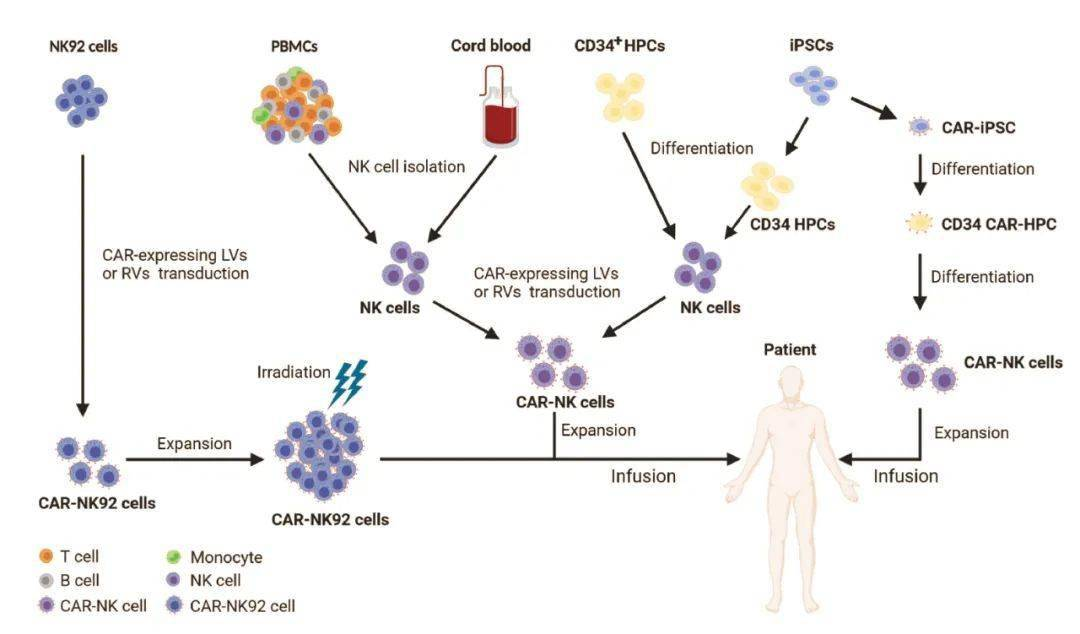
- 3)基因工程化NK细胞疗法:向患者输注基因改造的NK细胞,例如CAR修饰的NK细胞(CAR-NK)。
- 4)单克隆抗体(Monoclonal Antibody, mAb)疗法:根据抗体的靶向不同,可以分为两类:①采用靶向肿瘤相关抗原的治疗性抗体,例如靶向表皮生长因子受体(Epidermal Growth Factor Receptor, EGFR)的西妥昔单抗(Cetuximab)、靶向CD20的利妥昔单抗(Rituximab),通过NK细胞诱导ADCC效应达到治疗目的;②采用直接靶向NK细胞抑制受体的抗体,例如靶向NKG2A的莫那利珠单抗(Monalizumab),活化NK细胞对肿瘤细胞进行杀伤。
- 5)NK细胞衔接器(Engager):靶向肿瘤抗原(如CD19、CD20或EGFR)、NKp46和CD16的多功能抗体将肿瘤细胞和NK细胞结合在一起,从而触发毒杀肿瘤细胞机制和促进NK细胞分泌细胞因子。
作为抗癌的第一道防线,NK细胞已经成为免疫治疗临床试验中重要的一环。早在公元2000年,研究就已经证实小鼠癌症的发生和NK细胞自身的缺陷有关。随着NK细胞在抗肿瘤方面的探索愈发深入,越来越多的临床研究者希望了解NK细胞是如何对抗肿瘤的。
补充:CAR-NK细胞疗法的优势
1)内在杀伤能力
NK细胞是高度特化的细胞毒性细胞,依靠来自激活受体、抑制受体、细胞因子受体和趋化因子受体的多种信号的整合来识别和消除其靶标。一旦进入细胞毒性状态,NK细胞(与T细胞不同)在攻击靶标之前不需要任何的抗原启动,因此可以通过多种机制快速有效地杀死靶细胞。
2)特异性杀伤能力
通过基因编辑免疫细胞表达CAR会定向其特异性靶标,并将其杀伤能力集中在特定抗原上。CAR分子的基本结构包括由单链可变片段(scFv)组成的抗原识别结构域、细胞外铰链结构域、跨膜结构域和细胞内信号转导结构域。 其中scFv赋予了CAR特异性识别并结合靶抗原的能力,当CAR结构识别靶细胞后形成类似的免疫突触并启动免疫反应,促使免疫细胞杀死靶细胞。
3)安全性特征
在安全性能上,除了CAR-NK疗法能够在一定程度上避免巨大CRS和ICANS外,CAR-NK细胞的寿命比较短,这意味着CAR-NK在血液循环中停留的时间相对较短,不用顾虑CAR结构对机体的长期安全性问题。有人认为这一特性或许会导致CAR-NK细胞疗效不如CAR-T,但是从安全性的角度来说,这种特性反而避免了经过基因修饰的免疫细胞长期存在于人体可能导致的一系列未知的风险等。目前CAR-NK细胞已成为比较热门的研究方向,当然基于CAR疗法的研究其他细胞群也具有特定的优势。现阶段也有许多正在进行的早期临床试验来研究这些新的免疫细胞。
总的来说,CAR-NK是一种极具潜力的细胞疗法,相对比CAR-T来说安全性更好,且有望通过各种技术手段大规模生产即用或现货型产品,大大的降低了成本。当然CAR-NK作为一种新兴的细胞疗法同时面临着巨大的挑战,相信在不久的将来,随着技术的发展困难会迎刃而解。
NK细胞在不同疾病中的作用
NK细胞可以减轻或增强人类多种疾病的严重程度,根据不同的作用机制,科研人员正在开发针对不同疾病的基于NK细胞的治疗方案。
1)NK细胞与癌症
哈佛医学院皮肤科和癌症研究中心发表在《免疫学》杂志的一项研究成果NK细胞可以控制肿瘤的转移和生长,还可以降低癌症患者复发的风险。科学家发现,如果成年人的NK细胞活性较低,患癌症的风险就会增加。
2)NK细胞与病毒感染
在Science Translational Medicine杂志上发表的一项题为“Natural Killer cells for antiviral therapy”的文章中,证实了NK细胞可防御多种不同的病毒,如登革热病毒、呼吸道合胞病毒、西尼罗河病毒、流感病毒和日本脑炎病毒。
NK细胞可以抑制HIV的复制并破坏感染该病毒的细胞。NK细胞还可以通过产生IFN-γ等细胞因子来减少病毒在体内的传播。然而,在HIV-1感染过程中,会产生一种名为 Nef(负调节因子)的蛋白质,它可以帮助病毒感染的细胞逃避NK细胞的检测。在这种感染过程中,NK细胞上的激活受体减少,而抑制性受体显着增加。此外,NK细胞疗法可用于对标准治疗无反应的HIV患者。
3)NK细胞与糖尿病
在一篇题为“Targeting natural killer cell reactivity by employing antibody to NKp46: implications for type 1 diabetes”研究中,科学家发现NK细胞激活受体NKp46在1型糖尿病的发展中发挥着重要作用。NKp46与胰岛素分泌β细胞表面表达的配体结合,导致这些细胞遭到破坏。
NK细胞和其他免疫细胞会引起称为胰岛的胰腺区域的炎症。研究发现,长期患有糖尿病的患者,NK细胞激活受体的表达和NK细胞的活性降低。科学家还发现,施用阻断NKp46的抗体可以减轻NK细胞在糖尿病发生过程中的作用。
4)NK细胞与类风湿关节炎
NK细胞和其他免疫细胞可导致类风湿关节炎的关节破坏。这些细胞还可以通过产生IFN-γ来控制这种疾病的严重程度。
NK细胞在类风湿性关节炎患者的滑液中积聚,导致关节炎症。滑膜中的NK细胞产生信号分子,例如巨噬细胞集落刺激因子 (M-CSF) 和核因子κB受体活化因子配体(RANKL),可增加骨吸收。类风湿性关节炎患者外周血中NK细胞的细胞毒功能受损。
5)NK细胞与阿尔兹海默症
23年10月,阿尔茨海默病临床试验(CTAD)年会公布了研究性NK细胞疗法SNK01治疗阿尔茨海默病(AD)患者的I期试验数据。

▲I期临床实验研究的最终数据证明SNK01耐受性良好,似乎可以降低试验患者的阿尔茨海默病血液标志物:Aβ42/40淀粉样蛋白,并减轻神经炎症。并且90%的患者在11周后表现出改善或保持稳定的认知功能,这表明SNK01可能不仅仅缓解更能有效治疗阿尔茨海默症。
6)NK细胞与多发性硬化症
多发性硬化症患者的NK细胞数量较低。在这种疾病中,激活的T细胞会破坏神经纤维周围称为髓磷脂的绝缘层。NK细胞可以通过消除T细胞来控制这种疾病的严重程度。
7)NK细胞与系统性红斑狼疮
国际医学期刊《immunity》上的一篇文章介绍了一种来源于NK细胞的先天淋巴细胞种群——NKRM细胞,即组织驻留记忆自然杀伤细胞。这一细胞能够阻止自身过度免疫。
在小鼠实验中,研究人员初步证明了NKRM细胞可以通过TRAIL介导的方式消除CD4+T细胞,从而减少T细胞介导的自身免疫。这也意味着这一细胞疗法在治疗Sjogren综合征、系统性红斑狼疮等自身免疫疾病上具有潜力。
Part.6 总 结
NK细胞作为人体机能的调节者,协调组织重塑,诱导免疫耐受,对抗感染和疾病的第一线防御者。NK细胞具有很强的功能和表型可塑性,能够响应环境变化,显著改变其行为和特性。同时,NK细胞疗法不仅在血液肿瘤,还是转移性实体肿瘤,在正在进行的多项I/II期试验显示了可行性和潜在的疗效。NK细胞疗法的独特优势使它成为对抗肿瘤的多功能工具。在这个不断发展的环境中,NK细胞药物是有前途的药物,引导我们走向未来,癌症治疗不仅仅是一场战斗,而是一种个性化的、有针对性的、有效的治疗策略。
标签: