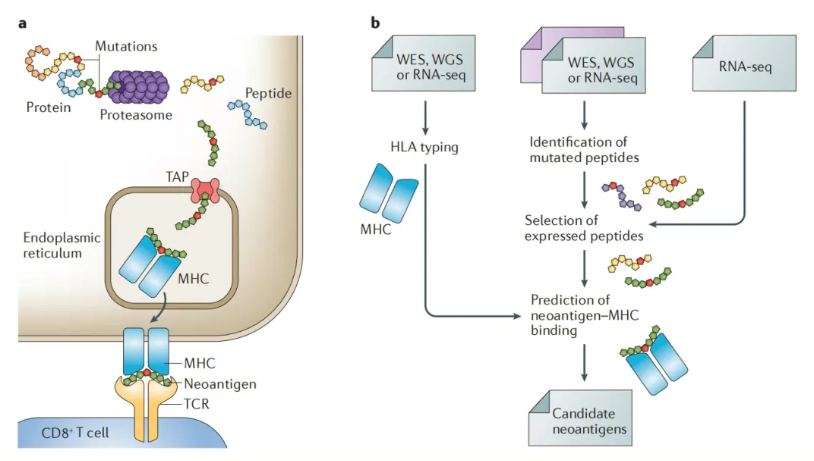
肿瘤新生抗原(Neoantigen)源自肿瘤细胞中的突变基因表达,属于肿瘤特异性抗原(TSAs),在正常组织器官中并不存在。那么,新抗原是如何引发免疫应答的呢?
首先,突变的蛋白质被水解加工成短肽(通常为 8~10 个氨基酸长的肽段)。这些肽段通过相关转运蛋白(TAP)运送至内质网,与细胞表面的主要组织相容性复合物(MHC)分子结合,形成 TCR-pMHC 复合物(TCR-peptide-MHC complex)并呈递到细胞表面。随后,通过 CD8+ T 细胞的 T 细胞受体(TCR)进行识别,进而触发 T 细胞免疫应答(图 1,a)。
Hackl H, Charoentong P, Finotello F, Trajanoski Z. Computational genomics tools for dissecting tumour-immune cell interactions. Nat Rev Genet. 2016;17(8):441–58.
02 丨肿瘤新抗原负荷(TNB)作为生物标志物
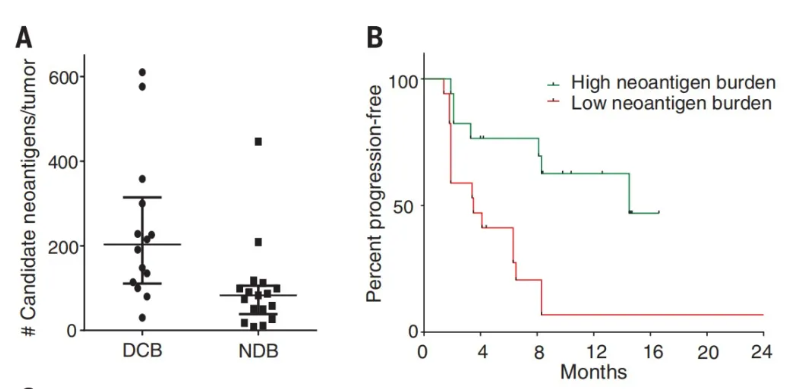
对于免疫抑制剂帕博丽珠单抗(2017 年美国 FDA 批准的 PD-1 抗体 Pembrolizumab)持续获益的非小细胞肺癌(NSCLC)患者,其肿瘤新抗原负荷(TNB)明显高于没有持续获益的患者(median 203 versus 83,Mann-Whitney P = 0.001)(图 2,A);并且 TNB 高的患者无进展生存期(PFS)也明显高于 TNB 低的患者(HR 0.23,95% CI 0.09 to 0.58,log-rank P = 0.002)(图 2,B)。该研究提示,PD-1 免疫抑制剂获益患者的 TNB 较高,且高 TNB 的患者比低 TNB 患者的 PFS 更长。
(DCB:durable clinical benefit,NDB:no durable benefit)
Rizvi, N. A. et al. Mutational landscape determines sensitivity to PD-1 blockade in non-small cell lung cancer. Science 348 , 124–128 (2015)
03 丨新抗原与肿瘤异质性(ITH)
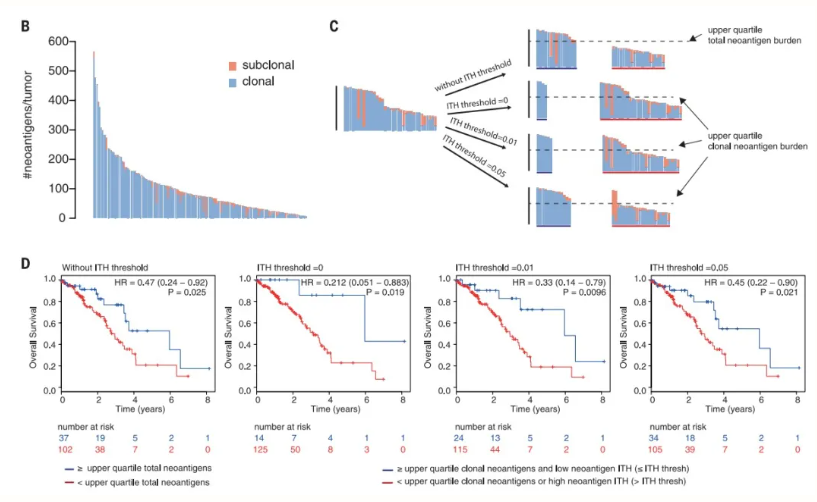
对应于不同的突变,肿瘤新生抗原会表现出肿瘤内异质性。其中一些新生抗原在所有瘤细胞中都存在(clonal neoantigens),还有一些只存在于一部分细胞中(subclonal neoantigens)。
使用不同的新抗原肿瘤内异质性(ITH)阈值,用条形图显示可将样本分离为两组。在没有 ITH 阈值的情况下,样本仅根据总新抗原负荷的上四分位进行分组。对于每个 ITH 阈值,克隆新抗原的上四分位用于分离具有高克隆和低克隆新抗原负荷的肿瘤,新抗原 ITH 阈值可进一步对样本进行分组(图 3,C)。
图3:TNB与肿瘤异质性(ITH)的关系
McGranahan, N. et al. Clonal neoantigens elicit T cell immunoreactivity and sensitivity to immune checkpoint blockade. Science, 351(6280), 1463-1469(2016)
不同 ITH 阈值下样本的总生存曲线显示:没有 ITH 阈值 [log-rank,P = 0.025,HR = 0.47(0.24 - 0.92)];ITH 阈值 = 0 [log-rank,P = 0.019,HR = 0.21(0.051 - 0.88)];ITH 阈值 = 0.01 [log-rank,P = 0.0096,HR = 0.33(0.14 - 0.79)];而 ITH 阈值 = 0.05 [log-rank,P = 0.021,HR = 0.45(0.22 - 0.90)](图 3,D)。
04 丨新抗原预测的一些不足
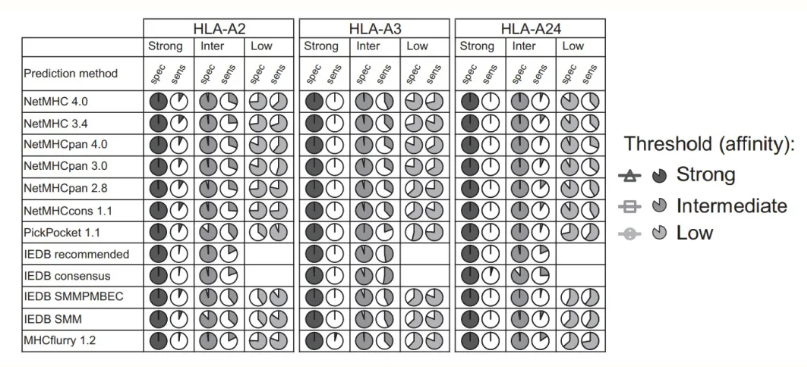
通过生物信息学方法预测新抗原主要关注多肽与 MHC 结合亲和力、蛋白酶体剪切、抗原转运蛋白(TAP)转运效率、表达丰度、肿瘤异质性、克隆性和 HLA 杂合性缺失(LOH)等因素。相关的工具及算法相当多,例如:IEDB(Immune Epitope Database)是一个抗体和 T 细胞表位实验数据的数据库,同时整合了一些 T 细胞表位预测工具;NetMHCpan4.0 整合亲和力和洗脱配体数据进行 MHC-I 分子相关作用预测。然而,如何选择计算机模拟工具并设置相关阈值以精准挑选出具有免疫原性的新抗原是一个不小的挑战。
Bonsack M, et al. Performance Evaluation of MHC Class-I Binding Prediction Tools Based on an Experimentally Validated MHC–Peptide Binding Data Set[J]. Cancer immunology research, 2019, 7(5): 719-736.
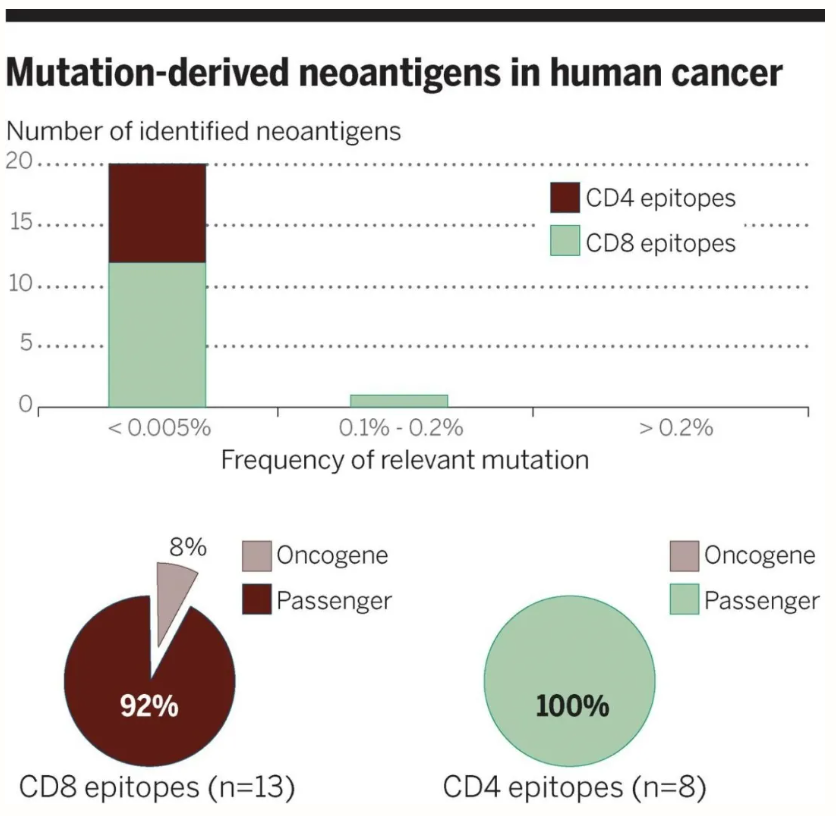
在约 20,000 个黑色素瘤的研究中发现了 20 种新抗原,新抗原出现在不同样本中的概率极低,并且 92% 的新抗原来自非驱动突变(passenger mutation)(图 5)。
Schumacher TN, et al. Neoantigens in cancer immunotherapy. Science 2015;348:69-74
目前,肿瘤新生抗原在开发上的主要挑战是如何准确地预测出真正的肿瘤新生抗原。由于其递呈过程多样且机制复杂,因此预测过程不能是简单的线性叠加。对预测出的肿瘤新生抗原需要进行 TCR 反应性的验证(如酶联免疫斑点试验 ELISPOT、四聚体等技术),但由于实验成本等因素,导致验证性数据相对较少。而基于机器学习和 AI 技术的预测算法需要通过验证性数据集的不断训练,其中数据类型、质量及体量都会极大地影响算法的精确度。
因此,数据库的不断累积,尤其是经过验证的肿瘤新生抗原数据累积,对于提升算法精确度具有极其关键的意义。随着二代测序技术的不断发展、预测免疫原性新抗原的计算机方法的开发和优化以及正在进行的临床试验,将会对新抗原预测产生积极影响,最终惠及肿瘤患者。