药品概述
9月13日上午,重组抗血管内皮生长因子人源化单克隆抗体I 期临床试验启动会在北京天坛医院神经外科神经肿瘤综合治疗病区示教室举行。
北京天坛医院神经外科神经肿瘤综合治疗病区主任李文斌教授、北京协和医院神经外科主任马文斌教授、北京天坛医院检验科主任张国军教授等专家出席了此次启动会,对临床试验方案进行了认真的讨论。
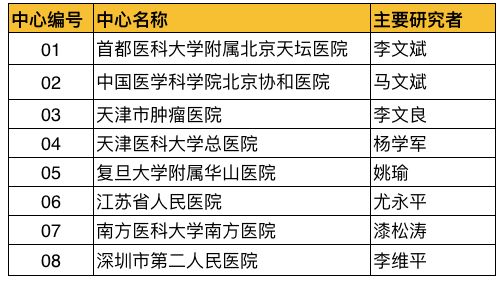
据悉,本次临床试验针对中国复发/进展型高级别脑胶质瘤患者(WHO分级III-IV级),组长单位为首都医科大学附属北京天坛医院,牵头PI为李文斌教授,国内共有8家中心参与了本次临床试验。
8家中心名单(见下图)
众所周知,目前国内晚期胶质瘤患者通常都面临着“无药可用”的局面。相关研究和数据显示,贝伐珠单抗虽然不能延长总生存期,但能够显著改善晚期胶质瘤患者的生存质量,贝伐珠单抗也是目前脑胶质瘤唯一可以使用的靶向药物。
目前,贝伐珠单抗未在中国申报胶质母细胞瘤适应症。在此背景下,由嘉和生物药业有限公司作为申办单位,启动了本次重组抗血管内皮生长因子人源化单克隆抗体(GB222)的I期临床试验。
重组抗血管内皮生长因子人源化单克隆抗体(GB222)是人源化单克隆抗体,与已上市贝伐珠单抗属同类产品。此前,对GB222与贝伐珠单抗在蛋白结构、理化特性和稳定性方面进行了比较研究,结果显示GB222单抗与贝伐珠单抗非常相似。
据悉,GB222在I期临床试验完成后,还计划分别开展单药单次的剂量递增及药代动力学研究和II/III期临床试验,探索GB222在脑瘤中的耐受性安全性及药代特征,并验证GB222用于治疗晚期胶质母细胞瘤的临床安全性和有效性,为药物获得胶质母细胞瘤适应症提供依据。