
近日,百时美施贵宝(Bristol-Myers Squibb )和默沙东(Merck )同时传来尿路上皮癌(一种膀胱癌)的临床好消息。
膀胱癌始于膀胱中的细胞开始不受控制地生长时,是美国第五最常诊断的癌症。 随着更多的癌细胞发展,它们可以形成肿瘤并扩散到身体的其他区域。尿道上皮癌是最常见的膀胱癌类型,起始于膀胱内部的尿道上皮细胞,它大约占病例的 90%。在 2016 年估计有 7.7 万个新增病例,1.6 万多人死于这种疾病。在北美、欧洲、北非、中东、澳大利亚和新西兰等地区,膀胱癌的发病率逐步升高。
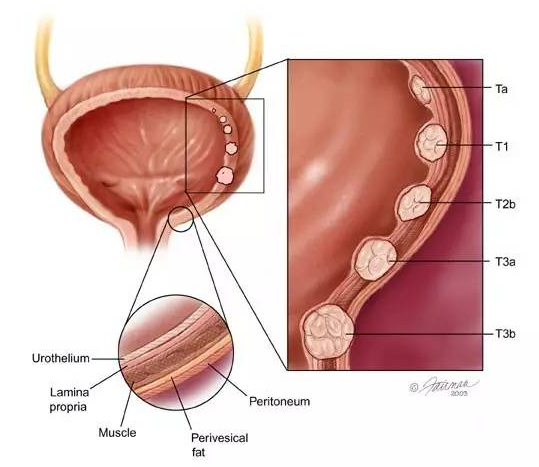
▲膀胱癌的发展(图片来源:dxline)
大多数膀胱癌在早期得到诊断,但复发率和进展率较高,约 50-70% 的患者将在五年内复发。在一线治疗中,响应的耐久性差是这个转移性疾病治疗的主要挑战;在二线治疗情况下,晚期尿路上皮癌存在有限的治疗选择。
近日,百时美施贵宝公司宣布,美国 FDA 已批准 Opdivo 静脉注射用于治疗晚期或转移性尿路上皮癌(mUC),这些患者在铂类化疗期间或之后疾病进展或在含铂化疗的新辅助或辅助治疗的 12 个月内具有疾病进展。该适应症是根据肿瘤反应率和反应持续时间在加速批准条件下获得批准的,长期持续批准可能取决于对验证性试验的临床获益的验证和描述。针对上述这个适应症,FDA 曾经向 Opdivo 授予了优先审评资格和突破性疗法认定。
此次获批主要基于显著的客观反应率。在一项名为 CheckMate-275 的开放标签、单臂、多中心研究中,研究人员评估了 Opdivo 在晚期或 mUC 患者中疗效和安全性。在该临床试验中,270 名患者接受 3mg/kg 剂量的 Opdivo,每两周静脉内施用,直到疾病进展或不可接受的毒性。推荐剂量为 240mg,以每两周 60 分钟的静脉内输注施用,直到疾病进展或不可接受的毒性。研究主要终点是由独立放射照相审查委员会(IRRC)定义的客观反应率(ORR)。参加研究患者的中位年龄为 66 岁(范围:38-90 岁),并且 29% 的患者在入组前在转移性状况中接受了 2 个先前全身性治疗方案。被选入试验的患者没有考虑他们的 PD-L1 表达状态。
在试验中,通过由 IRRC 定义的确定 ORR,在 270 名患者中评价了 6 个月随访的功效,Opdivo 证明了 ORR 为 19.6%(95%CI:15.1-24.9)。通过 PD-L1 表达分出的额外功效归纳总结如下:
百时美施贵宝公司负责美国范围市场的总裁 Chris Boerner 先生说道:“我们很高兴看到 Opdivo 获得又一批准,这使得我们帮助更多患者的目标得到进一步实现。我们的免疫肿瘤治疗方案为这些尿路上皮癌患者更多选择和潜在希望。
同一天,默沙东公司也宣布,美国 FDA 已接受审评 KEYTRUDA 的两个补充生物制剂许可证的申请(sBLA),用于治疗晚期或转移性尿路上皮癌。具体而言,一线治疗的申请被接受并获得优先审评资格,用于治疗不适合含顺铂化疗的患者。二线治疗的优先审评申请也被接受,治疗含铂化疗时或之后疾病进展的患者。这两个申请程序的目标操作日期 PDUFA 被定为 2017 年 6 月 14 日。
FDA 先前授予了 KEYTRUDA 的突破性疗法认定,用于在铂类化疗时或之后疾病进展的晚期或转移性尿路上皮癌患者的二线治疗。
该申请正在寻求批准 KEYTRUDA(pembrolizumab)单药治疗,剂量为 200 mg,每三周静脉内给药,分别基于 2 期 KEYNOTE-052 试验和 3 期 KEYNOTE-045 试验的数据。KEYNOTE-052 是一个开放标签研究,评估 KEYTRUDA 作为一线方案治疗晚期或转移性尿路上皮癌患者,他们不适合顺铂的治疗。 KEYNOTE-045 是一项随机研究,与研究人员选择化疗(紫杉醇、多西紫杉醇、长春氟宁)相比较,评估 KEYTRUDA 作为二线治疗晚期或转移性尿路上皮癌患者,他们的病情在含铂化疗中或之后复发或进展。在 2016 年 10 月,该公司宣布,虽然它没有显示出无进展生存期的显著改善,该试验满足其总体生存(OS)的共同主要终点,并在独立数据监测委员会(DMC)推荐下提前终止。
默沙东研究实验室肿瘤晚期发展高级副总裁兼治疗领域负责人 Roger Dansey 博士说道:“在过去的 30 年里,膀胱癌治疗的临床进展很少。 将 KEYTRUDA 用于晚期尿路上皮癌患者的数据是有希望的,我们期望在整个审评过程中与 FDA 合作,以便将 KEYTRUDA 提供给可能尽快受益的患者们。”
参考资料:
[1] Bristol-Myers Squibb (BMY) Receives FDA Approval For Opdivo (Nivolumab) In Previously Treated Locally Advanced Or Metastatic Urothelial Carcinoma, A Type Of Bladder Cancer
[2] FDA Accepts Two Sblas For Merck & Co. (MRK)s KEYTRUDA (Pembrolizumab) For Locally Advanced Or Metastatic Urothelial Cancer In Cisplatin-Ineligible First-Line And Second-Line Post-Platinum Failure Treatment Settings
扫描上面二维码在移动端打开阅读








