广州生物院首次揭示疟原虫作为肿瘤抗原表达载体的免疫机制
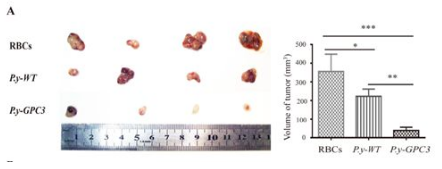
表达 GPC3 蛋白的疟原虫感染荷瘤小鼠肝脏肿瘤受到抑制
肿瘤免疫治疗是当前肿瘤治疗的前沿技术,利用抗原激活机体免疫是肿瘤疫苗的重要途径之一。然而,大部分抗原诱导的特异性免疫往往强度足够但持久性不足。3 月 2 日,国际学术期刊 Oncotarget 在线发表了中国科学院广州生物医药与健康研究院陈小平课题组关于肿瘤免疫治疗的最新研究成果。该论文首次揭示了疟原虫作为肿瘤抗原表达载体及其抗肝脏肿瘤(HCC,hepatocellular carcinoma)的免疫机制,这为疟原虫用于肿瘤免疫治疗提供有力的临床前数据支持。该研究是由广州生物院博士研究生刘权在研究员陈小平和副研究员秦莉的指导下完成的。
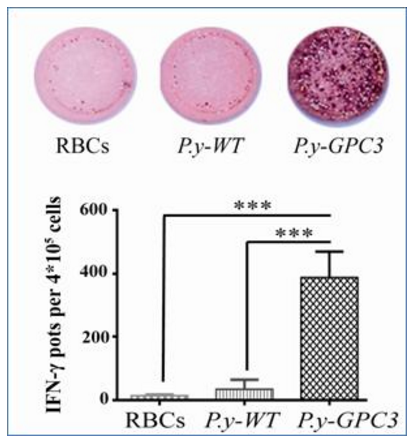
近年来,微生物或单细胞原生动物被用于肿瘤免疫治疗的研究受到了广泛的关注。该研究通过构建表达 GPC3 蛋白的疟原虫免疫荷瘤小鼠(P.y-GPC3),刺激机体产生针对 GPC3 的特异性 CD8+ T 淋巴细胞杀伤肿瘤细胞。研究表明,这与疟原虫能够激活 Th1 CD4+ T 细胞,并促进 CD8α+ DC 细胞成熟及其比例上调密切相关。
研究结果显示,表达 GPC3 蛋白的疟原虫在免疫小鼠后,小鼠肝脏肿瘤明显受到抑制,其生存率得到了显著提高。与此同时,疟原虫的持续感染为肿瘤抗原的长期表达和释放提供了良好条件。该研究进一步讨论了利用人疟原虫激活肿瘤特异性 CD8+ T 淋巴细胞杀伤肿瘤的可行性,随着疟原虫红内期及肝内期减毒虫株的深入研究,经基因改造的疟原虫用于肿瘤免疫治疗的临床前景非常值得期待。
扫描上面二维码在移动端打开阅读