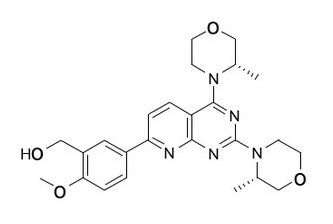
药品概述
AZD8055是一个由美国德克萨斯大学 A Naing 博士率领的研究团队,针对哺乳动物雷帕霉素复合物 (mTORC)1/mTORC2,对该靶点的一类双重抑制剂 AZD8055 进行了安全性、耐受性、药代动力学以及药效学评价研究。其研究结果在线发表于 2012 年 8 月 30 日的《英国癌症杂志》(British Journal of Cancer) 上。
这项针对 AZD8055 进行的临床 I 期研究所招募的患者为晚期恶性实体肿瘤患者,采用为非盲、剂量递增方式进行研究,每日口服用药两次 (BID),起始剂量为 10mg。
研究中共有 49 例患者服用了 AZD8055。A Naing 等人报告认为该药的剂量限制性毒性为 40 mg (n=1), 90 mg (n=1) 及 120 mg (n=3) BID;除 1 例出现肝脏转移的患者外,所有患者中出现的氨基转移酶升高均为 3 级,且均为可逆性。该研究确定 AZD8055 的最大耐受剂量为 90 mg BID。在评估中他们发现,发生频率最高的 AZD8055 相关不良事件为谷丙转氨酶升高 (22%),天冬氨酸转氨酶升高 (22%) 以及疲劳 (16%)。AZD8055 可以被快速吸收 ( 平均 tmax ~0.5 h),并且 AZD8055 的暴露量随着剂量增加而增加。有 7 例患者的病情稳定期≥4 个月。通过氟脱氧葡萄糖正电子发射断层扫描评估发现,局部代谢反应≥40 mg BID (n=8 ,第 35 天 )。
研究最终确定 AZD8055 的最大耐受剂量为 90 mg BID。除可引起氨基转移酶升高外,该药的毒性处于可接受的水平之内;然而根据实体瘤评价标准 (RECIST) ,研究未发现患者病情取得缓解。
这项针对 AZD8055 进行的临床 I 期研究所招募的患者为晚期恶性实体肿瘤患者,采用为非盲、剂量递增方式进行研究,每日口服用药两次 (BID),起始剂量为 10mg。
研究中共有 49 例患者服用了 AZD8055。A Naing 等人报告认为该药的剂量限制性毒性为 40 mg (n=1), 90 mg (n=1) 及 120 mg (n=3) BID;除 1 例出现肝脏转移的患者外,所有患者中出现的氨基转移酶升高均为 3 级,且均为可逆性。该研究确定 AZD8055 的最大耐受剂量为 90 mg BID。在评估中他们发现,发生频率最高的 AZD8055 相关不良事件为谷丙转氨酶升高 (22%),天冬氨酸转氨酶升高 (22%) 以及疲劳 (16%)。AZD8055 可以被快速吸收 ( 平均 tmax ~0.5 h),并且 AZD8055 的暴露量随着剂量增加而增加。有 7 例患者的病情稳定期≥4 个月。通过氟脱氧葡萄糖正电子发射断层扫描评估发现,局部代谢反应≥40 mg BID (n=8 ,第 35 天 )。
研究最终确定 AZD8055 的最大耐受剂量为 90 mg BID。除可引起氨基转移酶升高外,该药的毒性处于可接受的水平之内;然而根据实体瘤评价标准 (RECIST) ,研究未发现患者病情取得缓解。