据统计,癌症导致的死亡,有90%是肿瘤的转移导致的。在大部分人看来,肿瘤的转移过程大概是这样的:某些细胞在增殖的过程中出现突变,导致细胞生长失控,形成肿瘤;肿瘤细胞在不断分裂增殖的过程中,新的基因突变不断积累,直到某一天,有些肿瘤细胞意外获得了跟转移有关的基因突变,肿瘤细胞就表现出侵袭性;它们顺着血管随处扩散,转移到合适的器官,是为癌症。
目前在各国纷纷开展的「癌症登月计划」,也是以这个理论为基础展开的。大家都想通过对原发病灶的深度测序,达到理解、攻克和预测肿瘤治疗中出现的耐药问题。当然,如果在其他组织器官形成转移灶的扩散癌细胞,是来自我们测序取样时的那个肿瘤组织倒也罢了。然而,从2002年开始,陆续有研究表明(1-4),癌细胞在肿瘤形成非常早期的时候,就离开原发病灶,到其他组织器官独立安营扎寨了。这意味着什么恐怕也不用我多讲。

▲Julio A. Aguirre-Ghiso教授
可是学界一直以来并不清楚肿瘤细胞这种超早期转移背后的秘密,这样一来也就没办法找对策。终于,12月14日,来自美国纽约的西奈山伊坎医学院(Icahn School of Medicine at Mount Sinai,ISMMS)的Julio A. Aguirre-Ghiso教授团队(5)和德国雷根斯堡大学(University of Regensburg)的Christoph A. Klein博士团队(6),联合在《自然》杂志在线发表两篇文章,第一次阐明了癌细胞早期散播的机制。
让人震惊的是,他们还发现,在肿瘤形成早期就扩散出去的癌细胞,它在转移灶的定殖能力比肿瘤形成后散播出去的癌细胞更强。这简直颠覆了我们一贯以来对肿瘤转移的认识。这意味着,我们应该将目光更多的集中在肿瘤发生的早期阶段,研究已经成熟的肿瘤,可能并不能从根本上解决问题。Fred Hutchinson 癌症研究中心的Cyrus M. Ghajar和劳伦斯伯克利国家实验室的Mina J. Bissell联合在《自然》上撰文评价了他们的这一重要研究进展(7)。

▲Christoph A. Klein博士(橘黄色领带)
那Aguirre-Ghiso教授团队和Klein博士团队是如何发现这个秘密的呢?
首先,早在2003年的时候,Klein博士团队在乳腺癌研究中发现,散播在骨髓中的乳腺癌细胞的基因突变比原始病灶的癌细胞少很多(2)。这就意味着这些扩散出来的癌细胞出来的比较早啊,而且是在独立进化。
他们还找到了更多的证据证明,癌细胞的扩散实际上是伴随着肿瘤发生发展全过程的。例如,20%-30%被诊断为「非侵袭性」乳腺癌患者的骨髓里可以找到散播的癌细胞(8)。还有8%的「非侵袭性」乳腺癌会在离乳腺很远的发作(9)。而且,在所有的癌症患者中,还有5%左右的患者是找不到原发病灶的。这些证据至少能间接证明在肿瘤形成的早期,就已经有癌细胞扩散出去了。
在癌基因Her2过表达驱动的乳腺癌模式小鼠体内,科学家还发现,在小鼠才4周大的时候,小鼠的骨髓内就有扩散的癌细胞,而此时小鼠体内的癌基因Her2也才表达不久。而且这个时候的乳腺癌变,也只能通过电子显微镜看出来,在接下来的14周里才能发展成可触知的肿瘤(1)。这显然是直接证明了,的确存在癌细胞的超早期扩散。
▲电子显微镜下的乳腺癌细胞(图STAT:ANNE WESTON/WELLCOME IMAGES)
早期的时候,扩散的癌细胞侵袭性并不强,而且这个即将长肿瘤的地方甚至都没有血管,这些癌细胞是如何穿越重重细胞,进入血管到达骨髓的呢?
显然,Aguirre-Ghiso教授团队和Klein博士团队,此时的使命就是找到癌细胞早期扩散的机制。当然这个基础研究只能在模式小鼠里做,他们选择的也是癌基因Her2过表达驱动的乳腺癌模式小鼠。
Klein博士团队的课题负责人Hedayatollah Hosseini,在小鼠长到9周之前,取出小鼠乳腺导管的上皮细胞,分析上皮细胞的基因表达情况(6)。Hosseini发现是孕激素(progesterone)导致了癌细胞的扩散。乳腺导管上皮细胞有两种,一种有孕激素受体,一种没有。有孕激素受体的上皮细胞,在孕激素的刺激下,会分泌两种特殊的蛋白质(WNT4和RANKL),正是这两种蛋白质诱导没有孕激素受体的细胞脱离了乳腺导管,最终进入骨髓。
然而,Hosseini发现,随着肿瘤体积的不断增大,Her2蛋白不断积累,孕激素的作用受到抑制,肿瘤就从扩散状态切换到增殖状态。
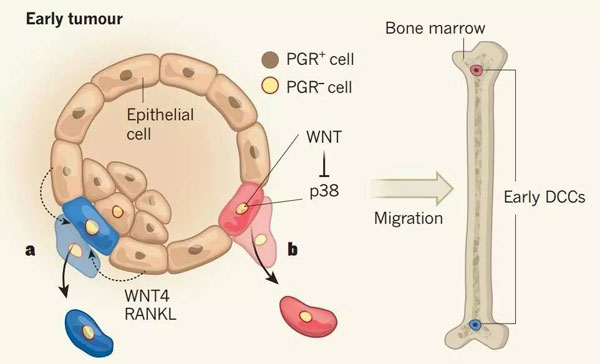
▲早期的肿瘤还不是很明显(7)。a,Hosseini等发现的机制,孕激素刺激有孕激素受体的上皮细胞(棕色小圆点)分泌WNT4和RANKL蛋白,促进没有孕激素受体的上皮细胞(土黄色小圆点,蓝色细胞)脱离乳腺导管,进入骨髓;b,Harper等发现的机制,Her2蛋白导致WNT蛋白增多,大量的WNT抑制p38蛋白的形成,导致没有孕激素受体的乳腺导管上皮细胞(红色)与周围细胞连接松动,脱离组织,进入骨髓。
Aguirre-Ghiso教授团队的课题负责人Kathryn L. Harper在平行的实验中发现了另一个机制(5)。小鼠体内表达的Her2蛋白会激活WNT蛋白,使WNT大幅增加;增加的WNT又抑制了p38蛋白的表达;而这个p38蛋白的作用就是加强细胞之间的联系,让细胞不脱离乳腺导管。由于p38蛋白受抑制,乳腺导管上皮细胞以早期癌细胞的形式进入了骨髓。
这两个团队还发现一个奇怪的现象,当把早期扩散的癌细胞和晚期扩散的癌细胞放到乳腺导管里时,早期扩散的癌细胞形成新病灶的能力比晚期扩散的癌细胞差。但是在转移部位形成病灶的能力,恰好是反过来的。
不过,这种机制目前还是在Her2驱动的乳腺癌中发现的,在其他类型的癌症中是否有这个现象,还需要进一步的研究,不过他们已经为后续的研究搭好了框架。在那些已经观察到存在早期癌细胞扩散的癌症(皮肤癌和胰腺癌)里,科学家可以尽快确定相关机制。
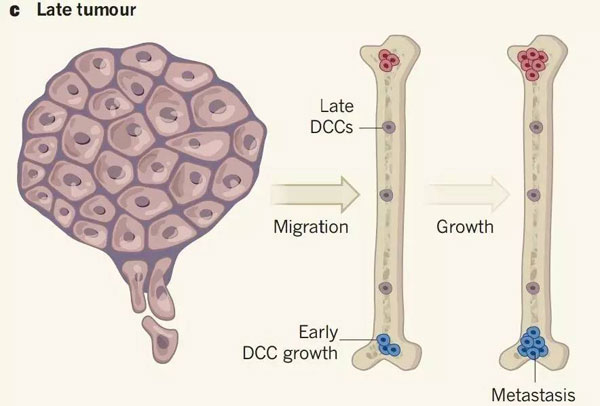
▲晚期肿瘤也有癌细胞扩散到骨髓,但是这些癌细胞在骨髓的定殖能力显然不如早期就扩散过来的癌细胞(7)。
Hosseini已经在人体中证实,早期扩散的癌细胞与原发病灶的癌细胞在分子水平上存在着显著的差异。因此Ghajar和Bissell表示,研究人员应该尽快从患者体内分离足够的早期扩散癌细胞,并做深入的研究分析。
更让人感到担心的是,现在的靶向治疗是利用原发病灶的信息开发来的,这极有可能使早期就扩散出去的癌细胞逃过药物的打击,这也可能是癌症容易复发和产生耐药性的深层次原因之一。
另外,这也对我们的癌症早筛体系提出了挑战。如果癌细胞的扩散是伴随着肿瘤的发生和形成全过程,如果不搞清楚早期扩散的癌细胞的特性,那么癌症早期筛查的意义又在哪里?毕竟,这个扩散过程应该远远早于现在我们定义的癌症早期。
「绝大多数患者被诊断为癌症时,癌细胞其实已经扩散了,」Aguirre-Ghiso教授在接受STAT采访时说,「这真是一个坏消息。但是我们还有机会干预,因为这个扩散出去的癌细胞并不会立即发作。」Aguirre-Ghiso教授团队正在寻找控制早期扩散出去癌细胞的开关。
对于携带Her2基因突变的女性(有25%的乳腺癌患者携带该突变),研究人员在接受COSMOS采访时建议,从目前的研究进度来看,她们可以考虑定期监测血液中的异常细胞。尽量尽早发现癌症的侵犯。
参考资料:
【1】Hüsemann Y, Geigl JB, Schubert F, Musiani P, Meyer M, et al. 2008. Systemic Spread Is an Early Step in Breast Cancer. Cancer Cell 13:58-68
【2】Schmidt-Kittler O, Ragg T, Daskalakis A, Granzow M, Ahr A, et al. 2003. From latent disseminated cells to overt metastasis: Genetic analysis of systemic breast cancer progression. Proceedings of the National Academy of Sciences 100:7737-42
【3】van de Wouw AJ, Janssen-Heijnen MLG, Coebergh JWW, Hillen HFP. 2002. Epidemiology of unknown primary tumours; incidence and population-based survival of 1285 patients in Southeast Netherlands, 1984–;1992. European Journal of Cancer 38:409-13
【4】Rhim Andrew D, Mirek Emily T, Aiello Nicole M, Maitra A, Bailey Jennifer M, et al. 2012. EMT and Dissemination Precede Pancreatic Tumor Formation. Cell 148:349-61
【5】Harper KL, Sosa MS, Entenberg D, Hosseini H, Cheung JF, et al. 2016. Mechanism of early dissemination and metastasis in Her2+ mammary cancer. Nature advance online publication
【6】Hosseini H, Obradovi? MMS, Hoffmann M, Harper KL, Sosa MS, et al. 2016. Early dissemination seeds metastasis in breast cancer. Nature advance online publication
【7】Ghajar CM, Bissell MJ. 2016. Metastasis: Pathways of parallel progression. Nature advance online publication
【8】S?nger N, Effenberger KE, Riethdorf S, Van Haasteren V, Gauwerky J, et al. 2011. Disseminated tumor cells in the bone marrow of patients with ductal carcinoma in situ. International Journal of Cancer 129:2522-6
【9】Narod SA, Iqbal J, Giannakeas V, Sopik V, Sun P. 2015. Breast cancer mortality after a diagnosis of ductal carcinoma in situ. JAMA Oncology 1:888-96
扫描上面二维码在移动端打开阅读