靶向药百科
*以上解读内容仅供参考,癌症123不对解读内容负责。
Entrectinib 恩曲替尼(Rozlytrek)治疗儿童肿瘤疗效如何?
2021-11-25 恩曲替尼Entrectinib已获得FDA的优先审查指定,作为选择NTRK融合阳性局部晚期或转移性实体肿瘤的成人和儿童患者以及转移性ROS1阳性非小细胞肺癌(NSCLC)患者的疗法。
Entrectinib 恩曲替尼(Rozlytrek)有哪些适应症?
2021-11-25 恩曲替尼(entrectinib)可通过血脑屏障,针对肿瘤驱动基因,不论原发部位。适用于治疗中枢神经系统肿瘤、神经内分泌肿瘤、唾液腺肿瘤、胰腺癌、非小细胞肺癌、甲状腺癌、
Entrectinib 恩曲替尼(Rozlytrek)有什么不良反应?
2021-11-25 恩曲替尼(entrectinib)是一种口服、选择性酪氨酸激酶抑制药(TRKI),靶向治疗携带原肌球蛋白受体激酶(NTRK)1/2/3或原癌基因酪氨酸蛋白激酶1(ROS1)的局部晚期或转移性实
Entrectinib 恩曲替尼(Rozlytrek)治疗效果怎么样?
2021-11-25 恩曲替尼(entrectinib)是一种具有中枢神经系统活性的酪氨酸激酶抑制剂(TKI),能够穿过血脑屏障,是临床上唯一一种被证明针对原发性和转移性脑疾病具有疗效的TRK抑制剂,并且
Entrectinib 恩曲替尼(Rozlytrek)的作用和功效
2021-11-25 恩曲替尼(entrectinib)是继拜耳-维特拉克-拉罗替尼(Larotrectinib)之后,全球上市的第二款靶向NTRK的口服跨病种广谱抗癌药。恩曲替尼(entrectinib)获批适应症包括:治疗N
Entrectinib 恩曲替尼(Rozlytrek)耐受性好吗?
2021-11-25 恩曲替尼的简介说明
罗氏旗下Ignyta公司在本月宣布了一种新型抗癌药物entrectinib(恩曲替尼)其作用原理是具有中枢神经活性的口服酪氨酸激酶抑制剂,主要针对NTRK1/2
罗氏旗下Ignyta公司在本月宣布了一种新型抗癌药物entrectinib(恩曲替尼)其作用原理是具有中枢神经活性的口服酪氨酸激酶抑制剂,主要针对NTRK1/2
Entrectinib 恩曲替尼(Rozlytrek)是不限年龄和癌种的抗癌神药吗?
2021-11-25 美国FDA加速批准恩曲替尼 (Entrectinib)上市,用于治疗ROS1阳性的转移性非小细胞肺癌(NSCLC)成年患者以及神经营养原肌球蛋白受体激酶(NTRK)基因融合阳性、初始治疗后疾
Entrectinib 恩曲替尼(Rozlytrek)获批的原因
2021-11-25 世界肺癌大会报道ROS1的数据,非常惊艳,尤其对于脑转移的患者,颅内ORR非常高。那时罗氏提出 persionalized healthcare V2.0 战略,利用强大的诊断和精准医学能力找靶点和
Entrectinib 恩曲替尼(Rozlytrek)适用于治疗哪些疾病?
2021-11-25 继在日本、美国及加拿大等国获批上市之后,2020年6月1日,欧洲药品管理局人用药品委员会(CHMP)推荐将恩曲替尼(entrectinib,Rozlytrek)用于治疗NTRK融合突变阳性的≥12岁的
近十年来,肺癌患者的治疗发生了巨大的变化。美国肺癌协会报道,美国的5年生存率从2009年的17.2%提高到2019年的21.7%。而肿瘤靶向药物的驱动基因检测、免疫检查点抑制剂
Nimotuzumab 尼妥珠单抗/泰欣生治疗儿童弥漫内生型桥脑胶质瘤效果如何?
2021-11-25 2019年12月13日,尼妥珠单抗联合同步放化疗治疗新诊断儿童弥漫内生型桥脑胶质瘤(DIPG)的多中心、前瞻性、单臂临床研究项目研究者会议在北京成功召开。
儿童弥漫性
儿童弥漫性
Nimotuzumab 尼妥珠单抗/泰欣生头颈部肿瘤用药临床应用指导
2021-11-25 通用名:尼妥珠单抗注射液制剂与规格: 针剂:50mg(10ml)/瓶 适应证:与放疗联合治疗 EGFR 基因阳性表达的Ⅲ~Ⅳ期鼻咽癌。
合理用药要点:
1.尼妥珠单抗冻融后抗
合理用药要点:
1.尼妥珠单抗冻融后抗
Apatinib 阿帕替尼/艾坦治疗复发胶质母细胞瘤的疗效和安全性
2021-11-25 胶质母细胞瘤(glioblastoma, GBM)是成人最常见的恶性脑肿瘤,约占所有胶质瘤的50%。GBM发病年龄多在壮年,对社会、家庭都是很大的打击。GBM生长迅速、侵袭性强,术后极易复发
Apatinib 阿帕替尼/艾坦临床治疗胃癌会有哪些副作用及如何处理?
2021-11-25 阿帕替尼是一种新型的高度选择性靶向血管内皮生长因子受体VEGFR2的小分子酪氨酸激酶抑制剂,在多种晚期肿瘤的治疗中显示出了一定的疗效。阿帕替尼可以通过抗血管生成
Apatinib 阿帕替尼/艾坦治疗胃癌患者临床效果好吗?
2021-11-25 胃癌是中国和世界范围内最常见的恶性肿瘤之一,据世界卫生组织国际癌症研究机构发布的GLOBOCAN 2018报告显示,我国年新发胃癌患者数在所有恶性肿瘤中排名第三位、年死亡
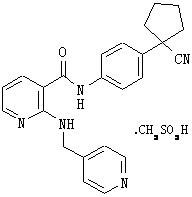
拉帕替尼(Lapatinib)与阿帕替尼(Apatinib)有什么区别?
2021-11-25 同样是治疗乳腺癌的药物拉帕替尼和阿帕替尼是只有一字之差,这两种药物是不是同一种药物呢?
阿帕替尼:阿帕替尼的化学名为甲磺酸N-[4-(氰基环戊基)苯基]{2-[(4-吡啶
阿帕替尼:阿帕替尼的化学名为甲磺酸N-[4-(氰基环戊基)苯基]{2-[(4-吡啶
肝癌患者用仑伐替尼还是阿帕替尼Apatinib好?
2021-11-25 临床上不少的医生会给肝癌患者开出阿帕替尼的处方,然而患者和家属都会有这个疑问,明明仑伐替尼才是对肝癌对症下药,为什么医生无视阿帕替尼的胃癌适应症,给超出适应症的肝
Apatinib 阿帕替尼/艾坦获批治疗的肿瘤有哪些?
2021-11-25 阿帕替尼是小分子血管内皮生长因子受体-2(VEGFR-2)酪氨酸激酶抑制剂,其主要作用机制是竞争性结合该受体胞内酪氨酸ATP结合位点,高度选择性地抑制VEGFR-2酪氨酸激酶活性,
Apatinib 阿帕替尼/艾坦常见不良反应的管理
2021-11-25 阿帕替尼是新一代小分子血管内皮生长因子受体-2(VEGFR-2)酪氨酸激酶抑制剂,可强效抑制肿瘤血管生成,从而发挥抗肿瘤作用。一系列研究已证明阿帕替尼在治疗胃癌、肝癌等
关于靶向药Apatinib 阿帕替尼/艾坦关心的问题汇总
2021-11-25 大部分的癌症患者和家属都会从医生那里或听到关于阿帕替尼的信息,而且医生经常无视阿帕替尼的适应症,给各种各样的癌症患者开阿帕替尼的处方。为了给患者一个更清晰的用
Gemtuzumab吉妥单抗/吉妥珠单抗(Mylotarg,麦罗塔)的作用机制和用法用量
2021-11-25 白血病新药吉妥珠单抗首款纳入儿童AML适应症的药物,也是唯一一种以CD33为靶点的AML治疗方法。2017年9月3日吉妥珠单抗获得美国食品药品监督管理局的批准,用于治疗新确
吉妥珠单抗是一种实验性抗体药物偶联物(ADC),由细胞毒性制剂卡奇霉素(calicheamicin)和靶向CD33的一种单克隆抗体偶联而成。CD33是一种抗原蛋白,表达于超过90%的AML患者的成
吉妥单抗(gemtuzumab ozogamicin)得到了美国FDA的批准,用于治疗表达CD33抗原的新诊断急性骨髓性白血病(AML)的成人患者。FDA同时也批准该药物用于治疗2岁及以上的CD33阳性A
吉妥单抗 (MYLOTARG)已于2017年9月1日获批治疗新发或复发难治的CD33阳性AML成人及2岁及以上儿童患者。该药物也是首款包括儿童AML适应证的药物。作为一种抗体药物偶联物
Gemtuzumab吉妥单抗/吉妥珠单抗(Mylotarg,麦罗塔)适用人群和注意事项
2021-11-25 2017年9月1日,美国食品和药物管理局批准吉妥单抗(Mylotarg,辉瑞公司)用于治疗成人新诊断的CD33阳性急性髓细胞性白血病(AML),并用于治疗复发性或难治性CD33阳性成人和2岁以